 |
Y±ýÀË´ú©ÒnªºDNA¬O§_¤w¶i¤J¬Y¤@±J¥D²ÓM¤¤, ¥i±N¦¹±J¥D²Óµß¥H¶î¥½Lªkªø¦b¥½L¤W¦A¥HnylonÂo¯È»\¤W, ±Nµß¸s¼Ò¦L¦bnylonÂo¯È¤W, ¦A±N¦¹Âo¯È¥H¹]µ§°µ¤W¥¿±(¦³µß¸s)¤§°O¸¹, ¨Ã¥H¦y°w¦bÂo¯È¤W¨ë¥|³B¤p¤Õ, ¨Ã»P°ö¾i¥×¤Wªº¬Û¹ï¦ì¸m¼Ð¦n, ¦p¡G
¥Íª«§Þ³N¹êÅç‰ë¦Ò¨BÆJ¡G
¥HLB°ö¾i²G(Luria©ÎLenox broth)°ö¾iE.Coli,
°ª·Å°ªÀ£®ø¬r«á¨Ï¥Î.
Y»s§@¥½L©Î¬vµæ±×±, «h¦b¤Wz¦¨¤À¥~, ¦A¥[1.5¢M(w/v)ªº¬vµæ¯».Y©|»Ý¥[¤J§Ü¥Í¯Àµ¥,
¥i¦b®ø¬r«á, «Ý²GÅé§N«o¦Ü¬ù50¢J®É, ¥[¤J²V©M.
Y»s§@³n¬vµæÂл\¼h¤§¬vµæ, «h¥Î0.7¢M(w/v)ªº¬vµæ¶q§Y¥i.
¤@¯ëY²K¥[§Ü¥Í¯À, ¨ä¿@«×¦p¤U¡G
|
|
Àx¦s²G¿@«× |
¨Ï¥Î²G¿@«× |
|
Ampicillin |
4mg/ml |
50£gg/ml |
|
Chloramphenicol |
10mg/ml (·»©ó¥Ò¾J) |
20£gg/ml |
Y¬O¥[¨ä¥L¤Æ¦Xª«, °Ñ¦Ò¿@«×¦p¤U¡G
|
|
Àx¦s¿@«× |
¨Ï¥Î²G¿@«× |
|
Isopropyl-I- |
100mM |
0.1mM |
|
thio-£]-D- |
(23.8mg/ml) |
(¨C¥½L¥[Àx¦s²G40£gl) |
|
galactoside
(IPTG) |
|
|
|
5-Bromo-4-chloro-3-indolyl-£]-D- |
20mg/ml |
20ug/ml |
|
galactoside(X-ga |
(·»©óN.N.dimethyl) |
(¨C¥½L¥[Àx¦s²G100£gl) |
|
l) |
Formamide |
|
±NE.coli°ö¾i¦bLB¤¤, 37¢J, 300rpm, ®¶Àú°ö¾i¹L©],
¥i±o¬ù
1-2¡Ñ107cells/ml, ¥ç¥i¥Î¥úÃлö´ú0D600, ¤j¬ù¨C0.10D¬Û·í108cells/ml,
¥ç¥i¥Îµ}ÄÀ¶î¥½LªkpºâColony Forming Unit (CFU)/ml,
Y·Q¤ÀÂ÷¦¹µß, ¥i¥Hµ}ÄÀ¶î¥ªk©Î¥½L¹º½uªk¬°¤§. «O¦s¦¹µß,
¥i±N¦¹µß¥[¤J¤U¦C¨âºØ·»²G¤¤¥ô¤@ºØ, ¨Ã«O¦s¦b-70¢J, »Ý¥Î®É,
§l¨ú³¡¤À, ¥Î©ó°ö¾i§Y¥i.
·»²G¤@¡Gglycerol solution
65¢Mglycerol
(v/v)
0.1M
MgSO4
0.025M
Tris.Cl, pH8
·»²G¤G¡GDMSO
Solution
7¢M(v/v)
dimethylsulforide (DMSO)
¡°·»²G¤@»Ý¸g°ª·Å°ªÀ£®ø¬r,
·»²G¤G¤£¥².
¹ê
Åç¡GE.coli¦¨ªø¦±½u
§÷®Æ»P¤èªk¡G
LB°ö¾i²G¤Î¥½L
E.coli
¦Û°Êp®É¾¹
¥Í²z¹êÆQ¤ô(0.9¢M)4.9ml
in 13¡Ñ100Á³»\¸ÕºÞ(§¡¸g®ø¬r)
Micropipettor
pipette
tips
Spreader
37¢J
incubatorn
37¢J«í·Å®¶Àú°ö¾i½c
¥»¥Í¿O
°sºë
¥Hµ}ÄÀ¶î¥½Lªk¬°¤§,
¨C30minp¼Æ¤@¦¸, ¥H180¤ÀÄÁ¬°¤§.
©Ò¦³¥Î©ó¶ù±µ´C¤¶(cloning vectors)ªº½èÅé, §¡¦³¤TÓ±ø¥ó¡G
1.
¤@ӽƻs°_©lÂI(a
replicator)
2.
¤@Ó¥i¿ï¾Üªº¼Ð»x(a
selectable marker)
3.
¤@Ó¶ù±µ°Ï(a
cloning site)
¬°¨Ï½èÅé¶q¦h, ¥i¥H§Ü¥Í¯Àchloramphenicol¾A·í³B²z,
¨Ï½èÅé¦bµßÅ餺¤j¶qÁc´Þ.¨äì¦]¬°chloramphenicol§í¨î³J¥Õ½è¥Í¦¨¡A«o¤£§í¨îDNA¦X¦¨¡C
1.
±N§tplasmidsªºµß²G1.5ml¥[¤JÂ÷¤ßºÞ,
Â÷¤ß13,000rpm, 30sec, §l°£¤W²M.
2.
¦bÂ÷¤ßºÞ¤¤¥[¤J200£gl cell suspension solution,
¤¤³tvortex 20sec, ¦A¥[¤J250£gl
cell lysis solution, ½w½w±NÂ÷¤ßºÞ¥¿ËÂà30¦¸, ¦A¥[¤J250£gl neutralization solution,
½w½w±NÂ÷¤ßºÞ¥¿ËÂà30¦¸.
3.
Â÷¤ß13,000rpm, 5min, ¤W²M²G¤¤§tplasmids.
4.
·Ç³Æ®M¦n1¤äSpin filter¦b1Ó1.5©Î2mlÂ÷¤ßºÞ¤¤,
±N¤W²M²G§l¤J, ¦A§l¤J200£gl quantum prep matrix(¥²¶·¥R¥÷²V¤Ã«á¨Ï¥Î),
¨Ã§l¤W§l¤U²V¦X, Â÷¤ß13,000rpm, 30sec.
5.
Ë¥h²GÅé, «®M¦nSpin filter,
¥[¤J500£gl wash buffer(¦¹wash
buffer¶·¤w¥[¤Jµ¥¶q°sºë), Â÷¤ß13,000rpm, 30sec.
6.
Ë¥h²GÅé, «®M¦nSpin filter,
¦A¥[¤J500£gl wash buffer, Â÷¤ß13,000rpm,
2min.
7.
±NSpin filter¸m¤J1¤ä·sÂ÷¤ßºÞ¤¤,
¦A¥[¤J100£gl(¦¹¶q¥i¨Ì©Ò»Ýplasmids¿@«×½Õ¾ã)¤w¥[¼ö¦Ü70¢J¤§dH2O,
Â÷¤ß13,000rpm, 1min,©Ò±o§Yplasmids.
8.
«O¦s©ó-20¢J.
±N½èÅé¥Ñ¤@ºØ±a¦¹½èÅ骺µßºØ¤¤´£¯Â«á,
¦AÂà´Ó¤J¥t¤@¤£±a¦¹½èÅ骺µßºØ¤¤,
¨Ã¥H¦¹½èÅé©Ò±aªº¥i¿ï¾Ü©Ê¼Ð»x¨ÓÀË´úÂà´Óµ²ªG.
¹ê
Åç¡G
§÷
®Æ¡G
¥H´£¯Â¤§§tLac
Z¡Ï¤§½èÅé(¨Ã§t§Ü¥Í¯ÀAmp, Tetracycline©Î¨ä¥L§Ü¥Í¯À¼Ð»x).
¤£§t¦¹½èÅé,
¥B¤£¯à¥NÁÂLactose¤§µßºØ.
2X
transformation and storage solution(TSS).
[°t¤è] ±N40¢M(W/V)¤§PEG3350¥HLBµ}ÄÀ¦Ü20¢M(¦¹PEG²G¤ÎLB²G§¡¸g®ø¬r¹L).
¥B¦¹LB²G¤¤§t¦³10mM¤§MgCl2, ¤§«á¥[DMSO¦Ü10¢M(V/V),
¨Ã½Õ¾ãpH¦Ü6.5.
LB²G§t20mM
Glucose
¤è
ªk¡G
1.
±N¹L©]¦¨ªø¤§µLPlasmidµß²G,
¥H1¡G5µ}ÄÀ©óLB²G¤¤, ¨Ï¦b37¢J, 300rpm®¶Àú°ö¾i½c¤¤ªø1hr.
2.
¨ú15ml¤Wzµß²G,
©ñ¤J¤@Â÷¤ßºÞ¤¤, ¥[¤Jµ¥¶q¤§2X TSS, ½w½w²V¦X, ¸m¦B¤W5min.
3.
Â÷¤ß4,000rpm, 5minË¥h¤W²M,
¦A¥[¤J3ml¤§1X TSS (¥H2XTSS ¥[®ø¬r¹L¤§dH2O¦Ó¦¨),
¨Ï²Óµß·»¸Ñ.
4.
¨ú100£gl¤§²Óµß, ¥[5£gl¤§½èÅéDNA(¤j¬ù1~100£gg DNA§Y¥i),
¥R¤À²V¦X(¦b¤@Ó1.5mlªºÂ÷¤ßºÞ¤¤), ¸m¦B¤W10min.
5.
¥[¤J0.9ml LB²G(¤º§t20mM glucose),
¸m37¢J, 30min, ¨C¹j3min²V¦X¤@¦¸, ¦b¥Hµ}ÄÀ¶î¥½Lªk,
±N²Óµß¶î¦b§tIPTG, X-Gal, ¤Î§Ü¥Í¯Àªº¥½L¤W.
6.
¥t¨ú¬°¥¼¸gÂà´Óªº²Óµß(§Y¨BÆJ4®É,
100£glµß¥[5£gl¤§T.E.¤£§t½èÅé),
¥çµ}ÄÀ¶î¥½L¬°¹ï·Ó²Õ.
¹w´Áµ²ªG¡G¤j¬ù107CFU/£gg DNAµ²ªG¥i¥Ñ¦¹¤èªk¹F¨ì.
£f(Lambda), ¥i§@¬°¶ù±µ´C¤¶(Cloning Vector),
¦]¨ä°ò¦]¤¤ªº¤@¬q»P¥¦ªºÁc´ÞµL«nÃö«Y, ¥i³Q§R°£,
¦Ó¥i±µ¤J¨ä¥L°ò¦]. ¦ý£fªº°ò¦]Y¤ñ³¥¥ÍºØ¦h(¶W¹L105¢M)©Î¤Ö(¤£¤Î78¢M)´N·|¼vÅT¦¹DNA¤£·|³Q¥]¤J¾½µßÅ餧´ß¤º.
±N£fªº°ò¦]»P½èÅé½Æ»sÂI¤Î¥i¿ï¾Ü¼Ð»xµ²¦X, ¦¨¬°comidªº£f
phage¥i«Iªþ±J¥D, ¨Ã±NDNAª`¤J±J¥D, ¦Óª`¤JªºDNA¬O½èÅé,
¦]¬°¥¦¨âºÝ§t¦³£f phageªºcos°Ï°ìDNA±Æ§Ç, ·|¨Ï¦¹ª½Ã쪬DNA§Î¦¨Àôª¬½èÅé(¥[¤W±J¥DDNA
ligase ªº¨ó§U). ¦p¦¹, ¦¹cosmid´N¥H½èÅé§Î¦¡¦b±J¥D¤¤Ác´Þ.
¹ê
Åç¡G£f¾½µßÅép¼Æ»P¯Â¤Æ
§÷
®Æ¡G
LB
(¤º§t0.2¢MW/V maltose¤Î10mM MgSO4),
¬vµæ¥½L¤Î³n¬vµæÂл\¼h(¨C¤ä¸ÕºÞ¤¤3ml)
µ}ÄÀ²G(Suspension
medium SM) (¸Ë¦b13¡Ñ100mm¸ÕºÞ¤¤¨C¤ä4.9ml)
[°t¤è]¨C¤½¤É§t¡G5.8g NaCl
2g MgSO4.7H2O
50ml 1M Tris.Cl,pH7.5
0.01¢M gelatin
55¢J¤ô¯D¾¹
·LªiÄl
¤è
ªk¡G
1.
±NE.Coli°ö¾i©ó§t0.2¢M(w/v)maltose¤Î10mM
Mg4SO²G¤¤, ¦]maltose¥i»¤¨ÏE.Coli¦h¥Í£f receptor(lamB
protein), ¦¹receptor¥ç¨ã¶Ç¿émaltose¥\¯à, Mg++Â÷¤l¥ç¦³§UlªþµÛ.
2.
±N³n¬vµæÂл\¼h¸ÕºÞ©ñ¤J·LªiÄl¤¤¨Ïªm,
±N¥H¿Ä¤Æ¤§³n¬vµæ¸ÕºÞ©ñ¤J55¢J¤ô¯D¾¹¤¤. (ª`·N¡G¸ÕºÞ»\¥²¶·ÃP¶}¤~¯à©ñ¤J·LªiÄl¤¤)
3.
¥H4.9ml¤§SM²GºÞ°µ£fªºµ}ÄÀ,
³v¦¸µ}ÄÀ4¦¸.
4.
±N¨C¦¸µ}ÄÀªº£f,
¦U¨ú0.1ml(¨C¦¸µ}ÄÀ°µ¤GÓ«½Æ), ¥[¤J¤@¤ä§t3ml³n¬vµæªº¸ÕºÞ¤¤,
½s¤W°O¸¹.
5.
¦b¦U§tµ}ÄÀ£f¤Î³n¬vµæªº¸ÕºÞ¤¤,
¥[¤J0.5ml¤§E.Coli½w½w²V¦X, ¸m55¢J, 3min.
6.
±N§t³n¬vµæ,
E.Coli¤Î£f phageªº¦U¤ä¸ÕºÞ¤À§OˤJ¬vµæ¥½L¤¤,
¨Ï§¡¤Ã¤À¥¬, «Ý§N«o«á, ±N¥½L˸m, ¼Ð¥Ü©ó©³³¡, ¨Ã±N¥½L©ñ37¢J°ö¾i½c¤º,
«Ý²Ä¤G¤épºâPlaque forming unit/ml(PFU/ml).
7.
Yn¨ú±o¯Â£f
phage, ¥u»Ý¥H®ø¬r¹L¤§¤úÅÒªg¨ú³æ¿W¤@Óplaque, ¦b©ñ¤JSM²G¤¤,
¨Ï£f phage¥i«O¦s¦b-70¢J. ±N¨Ónªø£f phage,
¥un¥Ñ¦¹«O¦s²G¤¤§l¨ú³¡¤À, ¥[¤JE.Coliµß²G¤¤°ö¾i, «ÝE.Coli³Q¯}Ãa,
£f phage¶q´N¼W¥[, ¤@¯ë¥i¹F1011PFU/ml.
¹ê
Åç¡G£f
phage¦¨ªø¦±½u
À³¥Îphagep¼Æ¦P¼Ëªº¤èªk, ¥u¬O¦b¶}©l®É, ¥t³Æ¤@E.Coliµß²G,
¦bO time®É¥[¤J©w¶q¤§£f phage, µM«á¨C¹j20minp¼Æ¤@¦¸, p120¤ÀÄÁ.
.¤».DNA¶qªº´ú©w
§÷
®Æ¡G
T.E.
buffer
¥úÃлö(¥i´ú250~300nm¥úÃÐ)
¥i³z¹Lµµ¥~½u¤§·L¶qcuvette
«Ý´úDNA
¤è
ªk¡G
1.
¥ý±N¥úÃлö·Å¾÷(warm
up).
2.
¥HT.E.
buffer¬°¼Ð·Ç²G, ´ú©w¼Ð·Ç²G.
3.
¥H1¡G50µ}ÄÀ«Ý´úDNA©óTE¤¤,
¦A´ú¨ä250~300nm¤§§l¦¬¥úÃÐ, ³Ì¥Dnn¨D±o260nm¤Î280nm¤§È.
4.
¨D260nm¤§§l¦¬È/280nm¤§§l¦¬È,
Y>1.7, «hDNA¸û¯Â¡FY<1.5«h¥i¦A¥Î«ezDNA¯Â¤Æªk¦A¥[¥H¯Â¤Æ.
Y©Ò±o¤§È>1.7, «h¥Î¦b260nm®É¤§§l¦¬È¼¥H50£gg/ml, ¦A¼¥Hµ}ÄÀ«Y¼Æ50, ©Ò±o¤§È§Y¬°¨Cml¤¤DNA¤§§t¶q.
.¤C.¿@ÁYDNAªº¤èªk
Y©Ò±o¤§DNA¯Â«×°÷, ¦ý¿@«×¤£¨¬, ¥i¥H¤Uªk¥[¥H¿@ÁY(¥Dn·Q±NDNA²G¤¤¤§¤ô¤À¥h±¼).
§÷
®Æ¡G
«Ý¿@ÁY¤§DNA
sec-butanol(2-butanol)
T.E.
buffer
diethyl
ether
¤è
ªk¡G
1.
±N«Ý¿@ÁYDNA¥ç»Pµ¥Åé¿n¤§sec-butanol¥[¤J,
¥R¤À²V¦X.
2.
«Ç·Å,
Â÷¤ß2,500rpm, 5min.
3.
Ë¥h¤W²M(¤W²M¬°§t¤ô¤§sec-butanol),
¥²n®É¥i«½Æ¦¹¤@µ{§Ç, ¨Ï¤ô¥÷¥R¤À²æ°£.
4.
¾A·íµ¥¶q¤§diethyl
ether»PTE buffer ¥R¤À²V¦X, ¸m«Ç·Å¤@¤ÀÄÁ, «Ý¤À¬°¤G¼h, ¤W´¿¬°ether,
±N¦¹¤W¼hether²G¨ú»P¿@ÁY«á¤§DNAµ¥¶q, ¥[¤J¿@ÁYº|¤§DNA²G¤¤,
¥R¤À²V¦X.
5.
¸m«Ç·Å2¤ÀÄÁ,
«Ý¤À¬°¤G¼h, ¤W¼h¬°ether, ¥i±N¤W¼h§l°£.
6.
´Ý¦s¤§ether¥i±NºÞ»\¥´¶}¬ù15¤ÀÄÁ,
«Ý¨ä¦ÛµM´§µo.
§÷
®Æ¡G
²GºA´á
Digestion
buffer
[°t¤è]100mM NaCl
10mM Tris.Cl,pH8
25mM EDTA, pH8
0.5¢Msodium dodecyl sulfate
¡°
0.1mglml proteinase K(proteinase K¥²¶·¦b¨C¦¸¨Ï¥Î«e¤~¥[¤J¥H«O¦³®Ä)
4¢J
Phosphate-buffered saline (PBS)
[°t¤è]10XÀx¦s²G¡G
¨C¤½¤É¤¤§t--80g
NaCl
2g KCl
11.5g
Na2HPO4.7H2O 2g KH2PO4
¨Ï¥Î²G(¤u§@²G)¡G
pH7.3--137mM
NaCl 2.7mM
KCl
4.3mM
Na2HPO4.7H2O 1.4mM KH2PO4
25¡G24¡G1
Phenol/Chloroform/isoamyl alcohol
7.5M
ammonium acetate
100¢M¤Î70¢Methanol
TE
brffer pH8
¤è
ªk¡G
1.
±N°Êª«²Õ´¤Á¤U,
¨³³t©ñ¤J²GºA´á¤¤, «Ý²Õ´áµw, ¥ß§Y¿i¦¨¯»ª¬.
2.
¨C100mg²Õ´¥[¤J1.2ml
digestion buffer. (Y«Y¥Î²Õ´°ö¾i²ÓM, «hÂ÷¤ß1000rpm, 5min,
¨I¾ý²ÓM, ¦A¥HPBS¬~²ÓM¤G¦¸, Â÷¤ß°£¥hPBS, ¦A±N²ÓM·»¦bdigestion
buffer¤¤, bufferªº¥Î¶q¬°¨C108²ÓM¥Î1ml).
3.
±N²Õ´©Î²ÓM©ñ¦bdigestion
buffer¤¤, ¦b50¢J, ®¶Àú12hr.
4.
¥Hµ¥Åé¿nªºPhenol/Chloroform/isoamyl
alcohol´£¨úDNA.
5.
Â÷¤ß2,500rpm,
10min, ¤W²M²G¤¤¬°DNA. (Y¤¤¶¡¼hªº¥Õ¦âª«½è¶q¦h,
¥i«½Æ¦¹´£¯Âµ{§Ç)
6.
±N¤W²M¤@Âà¦Ü¥t¤@Â÷¤ßºÞ¤¤,
¥[¤J1/2¿Åé¿n¶q¤§7.5M ammonium acetate, ¤Î¤W²M²G¶q2¿¤§100¢Methanol,
DNA·í«Ü§ÖªR¥X. ¦A¥HÂ÷¤ß2,500rpm, 2min, ¨I¾ýDNA, Ë¥h¤W²M.
7.
¥Î70¢Methanol¬~DNA,
¥H¥h°£ÆQ¤À¤Îphenol, Ë¥h°sºë, ¨ÏDNA°®Àê.
8.
±NDNA·»¤J¾A¶qTE¤¤,
¥i±NÂ÷¤ßºÞ©ñ65¢J¨Ã½w½w®¶Àú, ¥H¥[³t·»¸Ñ.
9.
±NDNA«O¦s¦b-20¢J(¥H1mg/ml¬°¨Î).
¹w´Áµ²ªG¡G¨C§J°Êª«²Õ´©Î¨C109Ó²ÓM¬ù¥i±o2mg
DNA.
.¤E. ¨Ï¥ÎNucleoSpin Tissue´£¯Â²Õ´,
²ÓM©Î²Óµß©Î¥Ç¸o²{³õ¤§DNA
ª`·N¡G
1.
¥ý±NBuffer
5²~(¦³2²~, ¦U7ml, ¥ý·Ç³Æ1²~, ¥Î§¹¦A·Ç³Æ¥t1²~)¤¤, ¥[¤J28mlªº99¢M°sºë,
¤ÎProteinase K²~¤¤¥[¤J1.35ml dH2O, ±N½Õ¦nªºProteinase K¤À¬°100£gl/¤ä, ¼Ð¥Ü«á, «O¦s©ó-20¢J.
¨Ï¥Î®É¨ú1¤ä¨Ï¥Î.
2.
Buffers B1, B3, (B3¬°B1»PB2ªºµ¥¶q²V¦X) BW¤¤§tgranidinium
hydrochloride, ¨Ï¥Î®É¶·À¹¤â®M.
3.
Ybuffer¤¤¦³¨H¾ý¥i¸m56¢J³B²z.
4.
¥ý³]©w2Ówater
bathes, ¤@¬°70¢J, ¤@¬°56¢J.
¨BÆJ¡G
1.
¨ú25mg°Êª«²Õ´,
¸m¤J1.5mlÂ÷¤ßºÞ, ¥[¤J75£gl phosphate buffered
saline(PBS), ¿i¸H¡F
¡¯Y¬°²Óµß,
¥Î1mlµß²G, Â÷¤ß7,500rpm, 5min, §l°£¤W²M, ±N²Óµß·»©ó170£gl¤§20mM Tris/Cl, 2mM
EDTA, 1¢MTriton, 20mg/ml lysozyme pH8¤§²G¤¤1hr, ¦A¶i¦æ¥[25£gl proteinase K, vortex 20sec, ¤Î¨ä«á¨BÆJ.
¡¯Y¬°°®¦åº{,
¥H¤M¤ù¤Á¤U§t¦åº{ª«¬ù15-30mm2, ¸m¤J1.5mlÂ÷¤ßºÞ, ¥[¤J180£gl T1, vortex 30sec, ¸m94¢J,
10min, ¥[¤J25£gl
proteinase K,vortex 30sec, ¸m56¢J, 1hr, ¨C10min, ¨ú¥Xvortex 20sec,
¥[¤J200£gl B3, vortex 30sec, ¸m56¢J, 10min, ¦A¶i¦æ¥Ñ²Ä5¨BÆJ¥H¤U¨BÆJ.
¡¯Y¬°¾v®Ú,
¦b1.5mlÂ÷¤ßºÞ¤¤, ±N100¤ä¾v®Ú¥[¤J180£gl T1²G, ¸m²GºA´á¤¤,
¦A¨ú¥X¸m56¢J, 1min, ¦p¦¹¤ÏÂÐ4¦¸. ¥[¤J25£gl
proteinase K, vortex 20sec, ¸m56¢J, ¹j©], ¦A¶i¦æ¨BÆJ4.
¡¯Y¬°ÁT«K,
¨ú250mgÁT«K·»©ó1ml TE¤¤(10mM Tris/Cl, 1mM EDTA, pH=8,) vortex 30sec,
Â÷¤ß5,000rpm, 15min, §l°£¤W²M, ±N¨H¾ýª«·»©ó1ml T1¤¤, vortex 15sec,
¥ß§Y§l¤W¼h²G200£gl¤J1·sÂ÷¤ßºÞ,
±µµÛ°µ¨BÆJ2.
¡¯Y¬°¦å²G,
¨ú200£gl¥þ¦å²G©Îbuffy coat, ¥[¤J25£gl proteinase K²G, ¥[¤J200£gl B3, vortex 15sec, ¸m70¢J,
15min, ¥[¤J210£gl, 99¢M°sºë, vortex
15sec, ±N©Ò¦³²GÅé§l¤J®M¦nªºNucleoSpin column¤¤, Â÷¤ß13,000rpm, 1minË¥h²GÅé,
¦A¥[¤J500£gl BW, Â÷¤ß13,000rpm, 1min, Ë¥h²GÅé, ¦A¥[¤J600£gl B5, Â÷¤ß13,000rpm, 1min,
Ë¥h²GÅé, ¦AÂ÷¤ß13,000rpm, 1min, Ë¥h²GÅé, ±NNucleoSpin column«¸Ë¦b1¤ä·sÂ÷¤ßºÞ¤¤,
¥[¤J¤w¹w¼ö¦Ü70¢JªºBE²G100£gl, ¸m«Ç·Å2min, Â÷¤ß13,000rpm,
2min, §Y±oDNA.
¡¯Y¬°²Õ´°ö¾i¤§°Êª«²ÓM,
¥HÂ÷¤ß1,000rpm, 4min, ¨H¾ý¨ú±o5¡Ñ106²ÓM, ¥[¤J180£gl T1¤Î25£gl proteinase K, vortex
15min, ¦A¸m56 ¢J, 10min, ¥[¤J200£gl B3, 210£gl°sºë, vortex 20sec, ¦A±µ²Ä6¨BÆJ.
2.
¥[¤J180£gl T1¤Î25£gl proteinase K, vortex 20sec.
3.
¸m56¢J
1hr, ¨C10min vortex 1¦¸, 15sec, (¥²n®É¥i¥tÁÊRNase¥[¤J)
4.
vortex 20sec, ¥[¤J200£gl
B3, vortex 20sec, ¸m70¢J, 10min.
5.
¥[¤J210£gl °sºë, vortex 20sec.
6.
¸Ë§´1²ÕNucleoSpin®M²Õ,
±N²GÅé§l¤J, Â÷¤ß10,000rpm, 2min, Ë¥h²GÅé, «¸Ë§´NucleoSpin®M²Õ.
7.
¥[¤J500£gl BW, Â÷¤ß10,000rpm, 1min, Ë¥h²GÅé, «¸Ë§´NucleoSpin®M²Õ.
8.
¥[¤J600£gl B5, Â÷¤ß10,000rpm, 1min, Ë¥h²GÅé, «¸Ë§´NucleoSpin
®M²Õ.
9.
Â÷¤ß13,000rpm,
3min, Ë¥h²GÅé, «¸Ë§´NucleoSpin®M²Õ©ó1¤ä·sªº1.5mlÂ÷¤ßºÞ¤¤.
10.¥[¤J200£gl¹w¼ö¦Ü70¢JªºBE buffer, ¸m«Ç·Å2min, Â÷¤ß13,000rpm,
1min, ©Ò±o§YDNA.
Y©Ò±oDNA¤§A260/280<1.6, ¥i¥[¤Jµ¥¶q(1volume)B3¤Îµ¥¶q99¢Malcohol,
vortex 10sec, ¦A±N²GÅé§l¤JNucleoSpin ®M²Õ¤¤, Â÷¤ß13,000rpm, 1min,
Ë¥h²GÅé, ¦A¥[¤J500£gl BW²G, Â÷¤ß10,000rpm,
1min, Ë¥h²GÅé, ¦A¥[¤J600£gl
B5²G, Â÷¤ß10,000rpm, 1min, Ë¥h²GÅé, ¦AÂ÷¤ß 13,000rpm, 3min, «¸Ë§´NucleoSpin®M²Õ©ó1¤ä·sªº1.5mlÂ÷¤ßºÞ¤¤,
¥[¤J200£gl¹w¼ö¦Ü70¢JªºBE
buffer, ¸m«Ç·Å2min, Â÷¤ß13,000rpm, 1min, ©Ò±o§YDNA.
.¤Q.¨Ï¥ÎCoulter
Counter Z1¤èªk
¨Ï¥Î«e¥ý±NDiluent ²~¸Ë¤JIsotonII¦Ü¤Ö¥b²~, ±NWaste²~˪Å.
±N´ú¸ÕªM¸Ëº¡Isoton¸m¼Ë«~¥x, 擡°ª¼Ë«~¥x,
¨Ï´ú¸ÕºÞ¤Î¹qªMªw¦bIsoton¤º.
1.
¥´¶}¹q·½,
«öFunctionÁä, (¥Î¡Õ, ¡Ö¨Ó¿ï©Ònªº¶µ¥Ø, ¿ï©w«á«öStart/StopÁä§Y¥i),
¥ý¿ïFill System, «öStart, ¦A«ö1¦¸Start. ¾÷¾¹§Y¶}©l©âIsoton¤JºÞ12¦¸.
«Ý§¹¦¨«á;
2.
«öset-up,
½T»{aperture¬°100£gm, Kd=60, select Units¬°£gm, lower size=2.0£gm, volume=0.5ml, ¦A«öset-up,
¾÷¾¹·|½Õ¾ã³]©w¤§°Ñ¼Æ, ¦A«öset-up, ¬Ý³]©wȹï§_, ¹ï, «h¦A«öset-up,
¦¹®É¾÷¾¹·|¦C¥X§¹¾ã°Ñ¼Æ, ¥i¥Î¡Õ, ¡Ö¨Ó¿ï, ¿ï¦n«öStart,
§Y¶}©lp¼Æ.
3.
¨Ï¥Î§¹,
±NCoulter Cleanz²G¸Ë¤J´ú¸ÕªM, «öPrime, ¾÷¾¹·|²M¬~ºÞ¤l8¦¸, ¦A´«dH2O¸Ë¤J´ú¸ÕªM,
«öPrime, ¾÷¾¹·|¦A²M¬~ºÞ¤l8¦¸, µM«áÃö¾÷.
§÷
®Æ¡G
®ø¬r¹L¤§dH2O,
4¢J
²GºA´á
Extraction
buffer
[°t¤è]100mM
Tris.Cl, pH8 100mM
EDTA
250mM
NaCl
100£gg/ml proteinase K
10¢M(W/V)
N-lauroyl sracosine (SarKosyl)
100¢M¤Î70¢Methanol
TE
buffer
7.5M
ammonium acetate
¤è ªk ¤@¡G
1.
¨ú¥®¹à´Óª«²Õ´10~30g,
¥HdH2O²M¬~, ´½°®.
2.
¥H²GºA´á±N´Óª«²Õ´§Ná,
¿i¦¨¯».
3.
±N¯»¸Ë¤JÂ÷¤ßºÞ,
¥[¤Jextraction buffer (¨C§J´Óª«²Õ´¥[10ml extraction buffer),
¥R¤À²V¦X. ¦A¥[¤J¾A¶q¤§10¢MSarKosyl¨Ï³Ì²×¿@«×¦¨¬°1¢M.
4.
¸m55¢J,
1hr.
5.
Â÷¤ß10min,
6,000rpm, 4¢J, «O¯d¤W²M, ¦Ü¥t¤@Â÷¤ßºÞ¤¤.
6.
¥[¤J¤W²M²G0.6¿ªºisopropanol½w½w²V¦X.
DNAÀ³§YªR¥X, §_«h¸m-20¢J,
30min.
7.
Â÷¤ß8,000rpm,
4¢J, 15min, Ë¥h¤W²M. ¦A±NDNA·»©ó¾A¶qTE¤¤.
8.
±µ¤U¨Ó¥i¥Î¯Â¤ÆDNAªº¤èªk¯Â¤ÆDNA
(§Y25¡G24¡G1¤§Phenol/Chloroform/isoamyl alcohol)µ¥¶q²V¦X, Â÷¤ß2,800rpm,
10min, ¤W²M²G¤¤¬°DNA.
9.
±N¤W²M²GÂà¦Ü¥t¤@Â÷¤ßºÞ¤¤,
¥[¤J1/2¿Åé¿n¶q¤§7.5M ammonium acetate, ¥H¤Î¤W²M²G¶q2¿¤§100¢Methanol,
ªR¥XDNA. ¦A¥H2,800, 2min, Â÷¤ß, ¨I¾ýDNA, Ë¥h¤W²M.
10.¥Î70¢Methanol¬~DNA,
¥H¥h°£ÆQ¤À§Yphenol, Ë¥h°sºë, ±NDNA·»©ó¾A¶qTE¤¤.
11.±NDNA«O¦s¦b-20¢J.
¥Î¦¹ªk©Ò±o¤§DNA·|§t¦³²É¸¢Åé¤Î¸ºñÅ餤ªºDNA,
n·Q±o¨ì¯Â´Óª«DNA, n¥Î¶W°ª³tÂ÷¤ß¾÷¤ÀÂ÷.
¥H¦¹ªk©Ò±o¤§DNA¶q,
¤j¬ù¬O¨C§J´Óª«10¦Ü40£gg DNA.
1.
¨ú25g´Óª«¥®¸¬~²b, ¸m¬ã²Ú¤¤,
¥[¤J25mlÂfÂc»Ä¯Ç²G(°t¤è¡G¨C¤½¤ÉdH2O¤¤¥[8.18g Na
citrate°ª·Å°ªÀ£®ø¬r), ¬ã¿i¦¨ªdª¬.
2.
¥[¤J150ml§¡½è¤Æ²G(Homogenization
Solution) (°t¤è¡G¨C¤½¤ÉdH2O¤¤¥[Na lauryl sulfate 100.0g, Na
citrate 2.94g, NaCl 8.18g, °ª·Å°ªÀ£®ø¬r), ¦AÄ~Äò¬ã¿i30min,
±N¦¹ªdª¬²G¥HÂù¼h¯½¥¬¹LÂo, ¨ÃÀ½¥X¯½¥¬¤Wªº²GÅé.
3.
±N²GÅé¾A¶q§¡¤À¸mÂ÷¤ßºÞ,
¤À§O¥[¤J2¿Åé¿nªº99¢M°sºë, Â÷¤ß200xg, 5min, (4¢J), Ë¥h¤W²M,
¦¹¨I¾ý¤¤§t²ÓM®Ö, ¥[¤Jì²GÅé¿n1.5¿¶qªºNaCl²G
(°t¤è¡G¨C¤½¤ÉdH2O¤¤¥[NaCl 81.8, °ª·Å°ªÀ£®ø¬r),
¥R¤À²V¦X, Â÷¤ß10,000xg, 25min, 20¢J,
±N¤W²M²GˤJ¤@²M¼äµLµß¤p¿NªM, «O¯d.
4.
¦A¥[¤J15ml NaCl²G¦ÜÂ÷¤ßºÞ¤¤,
¥R¤À²V¦X, ¦AÂ÷¤ß10,000xg, 25min,
20¢J.
5.
±N¤W²M²GˤJ«e¤w¦³¤W²M²GˤJªº¦P¤@²M¼äµLµß¤p¿NªM¤¤,
½w½w¥[¤Jµ¥Åé¿nªº99¢M°sºë, ¨Ã¥H¬Á´ÎÅÍ©Õ, ¦¹®ÉDNA·|¶¦A¬Á´Î¤W,
Ä~ÄòÅÍ©Õ, ¦ÜDNA¤£¦A¶¦b¬Á´Î¤W.
¨Ï¥ÎQuantum
Prep AquaPure Genomeic DNA KitµÑ¨ú²ÓµßDNA
1.
¨úE.coli
overnight culture 500£gl, ¸m¤J1.5mlÂ÷¤ßºÞ,
¸m¦B¤W, Â÷¤ß10,000rpm 15sec, §l°£¤W²M²G, ¦A¥[¤J300£gl
genomic lysis buffer, ¨Ï²Óµß¥R¥÷·»¸Ñ, ¸m80¢J¤ô¯D©Îhotblock¤W, 5min.
2.
±N¤WzÂ÷¤ßºÞ¸m«Ç·Å5min,
¥[¤J1.5£gl RNase solution,¥R¥÷²V¦X,¸m37¢J, 45min,
¦A±N¤WzÂ÷¤ßºÞ¸m«Ç·Å5min, ¦A¥[¤J100£gl protein precipitation
solution, vortex 30sec, Â÷¤ß11,000rpm, 3min.
3.
«O¯d¤W²M²G©ó¥t¤@Ó1.5mlÂ÷¤ßºÞ¤¤,
¥[¤J300£gl 100¢Misopropanol, ¥R¥÷²V¦X, Â÷¤ß13,000rpm, 2min,
Ë¥h¤W²M, ¥H300£gl 70¢M°sºë½w¬~¨H¾ý¤§DNA,
Â÷¤ß13,000rpm, 1min, Ë¥h¤W²M, Ãw°®.
4.
¥[¤J50~100£gl DNA hydration buffer, ¸m65¢J¤ô¯D©Îhotblock¤W,
5~30min. ¨ÏDNA¥R¤À·»¸Ñ. «O¦s©ó-20¢J.
.¤Q¥|.´Óª«²Õ´°ö¾i»P¥Íª«§Þ³N
±N±ý°µ²Õ´°ö¾iªº´Óª«²M¬~°®²b, ¦A®û¤J70¢M°sºë20¬í,¦A®û¤J§t0.05¢MTween
20©ÎTriton-100ªº0.25¢Mº}¥Õ¤ô(NaOCl), ©Î3¢MH2O2,
©Î1¢MAgNO3¤¤20min,(¥i¸m©ó¶Wµªi¼Ñ¤¤³B²z).
¦A¥HµLµß»]ÃH¤ô®û¬~3¦¸, ¨C¦¸5min.
¡¯¥H¬õù¸²¬°¨Ò¡G
±N¬õù¸²¥~ªí¬~²M«á,
¥HµLµß¸Ñå¤M, ¤Á¥X¤@Á¡¶ê¶ô, ¦A¥H¤Wz¨BÆJ®ø¬r«á, ¦A¤Á¥X1¤p¶ô§Î¦¨¼h(cambium)³¡¥÷,
¦¹¤p¶ô¥i¦A¤À¤Á¬°¦h¶ô, ¤À¸mµLµß¥B§t¡¶Ë²Õ´»¤µo²G(Callus-induction
medium) (°t¤è¡G1x Murashige and Skoog medium[MS medium] 1¤½¤É, 2,4-D 1.0mg,
pH¡×5.5[¥Î0.1M NaOH½Õ]), Yn©TºA«h¥[¤J8.0g agar, °ª·Å°ªÀ£®ø¬r)ªºµLµß¦³»\¸ÕºÞ¤¤,
°ö¾i²G¤£¶W¹L¤p¶ôªí±, ¸m«Ç·Å, ¤é¥ú¿O¤U, ¬ù4¶g,
¥i¨£Â¡¶Ë²Õ´.
¥H¥É¦ÌF¬°¨Ò¡G
¥ý±N¥É¦Ì²É¥H«e×ä¤è¦¡®ø¬r,
¦A¸mµLµß°ö¾i¥×¤¤, ¸m«Ç·Å·t³B, ¥HµLµß»]ÃH¤ô®û1¤é, ²Ä2¤é,
¥HµLµß¸Ñå¤M, ±NF¥H¥~³¡¥÷¤Á°£, ±NFÂಾ¦Ü§tF°ö¾i°ò(Embryo
Culture Medium)¥½L¤¤ (°t¤è¡G1x MS medium 1¤½¤É, pH¡×5.5[¥Î0.1M NaOH½Õ]), Yn©TºA«h¥[¤J8.0g agar,
°ª·Å°ªÀ£®ø¬r, «Ý·Å«×°¦Ü50¢J¥ª¥kË¥½L). ¥½L©P³ò¥Hparafilm«Ê¦n,
¸m«Ç·Å·t³B. ¦b1¶g¤º¥i¨£®Ú, ²ô, ªø¥X.
¥H§ß®á¸¬°¨Ò¡G
¨ú¥®§ß®á¸,
¥H«e×ä¤è¦¡®ø¬r, ¦A¨ú¤¤¶¡¦³¸¯ß³¡¥÷, ¤Á¦¨1cm2¤p¶ô,
¸m¤J§t·L¶qÁc´Þ²G(Micropropagation Medium)(°t¤è¡G1x MS medium 1¤½¤É,
Indolebutyric acid [IBA] 1.0 mg, Benzylaminopurine[BAP] 3.0 mg, pH = 5.5[¥Î0.1M
NaOH½Õ], Yn©TºA«h¥[¤J8.0g agar, °ª·Å°ªÀ£®ø¬r, «Ý·Å«×°¦Ü50¢J¥ª¥kˤJ¼s¤fÀ@²~¤¤),
»\¦n, ¸m«Ç·Å¤é¥ú¿O¤U, ¬ù6¶g, ¥i¨£®Ú, ²ô, ªø¥X.
.¤Q¤.´Óª«ì¥Í½èÅé(protoplast)¤ÀÂ÷»P³B²z
´Óª«ì¥Í½èÅé¬O¤£¨ã²ÓM¾Àªº´Óª«²ÓM.
¥H§ùÃYªá¬°¨Ò¡G
¨ú§ùÃYªá¨Ì«e×äªk®ø¬r«á,
¤Á¦¨¬ù1mm¼e±øª¬, ¸mµLµß°ö¾i¥×¤¤§t10ml²ÓM¾Àµõ¸Ñ²G(Cell Wall
Lysis Solution)(°t¤è:¨C100ml»]ÃH¤ô¤¤§tcellulase 2.0g, mannitol 10.27g, [¥ý·»mannitol],
¦A¥H¹LÂoªk®ø¬r), ¸m«Ç·Å·L¥ú¤U1¤é. ²Ä2¤é,¥i±N°ö¾i¥×¸m¸ÑåÅã·LÃè¤U,¥HµLµß§lºÞ±Nì¥Í½èÅé§l¥X¥t¦æ°ö¾i©óMS²G¤¤,¦A¨ú¤Ö³\¥H0.3¢Mtrypan
blue¬V¦â, ¦b´¶³qÅã·LÃè¤UÆ[¹î, ¬¡²ÓM·|±Æ°£trypan blue,
¦º²ÓM¤£·|.
.¤Q¤».¥Õ¦å²y¬V¦âÅ骺¤ÀÂ÷
1.
©â¦å5ml¤J§t§Ü¾®¦å¾¯ªº¸ÕºÞ¤¤,
Â÷¤ß2,500rpm, 10min, ¥H·L¶q§lºÞ§l¨ú¥Õ¦å²y¼h, ¸m¤J1.5mlÂ÷¤ßºÞ¤¤.
¥[¤J600£gl red blood cell lysis
buffer, ¥ý¥R¥÷²V¦X«á, ¦A¸m¥»O³¼±×¾¹¤W½w½w²V¦X5min, Â÷¤ß3,000rpm,
5min, §l°£¬õ¦â¤W²M²G.
2.
±N1ml¤w¸g°ª·Å°ªÀ£®ø¬r¹L¥B¤w¥[¤J5¢M¤û¦å²M¤Î§t2¡Ñ10-3mM L-glutamineªºMEM²Õ´°ö¾i²G¥[¤J¤WzÂ÷¤ßºÞ¤¤,
¥R¥÷²V¦X, ±N¦¹§t¥Õ¦å²yªº°ö¾i²G¥þ³¡§l¥X, ¸m¤J25cm2ªº²Õ´°ö¾i¥×¤¤,
¦A¥[¤J4mlªº¤WzMEM²Õ´°ö¾i²G, ¦A¥[¤JµLµß¬î¤ô¥P¯À(colcemid),¨Ï³Ì²×¿@«×¬°10-2£gM,
±N²Õ´°ö¾i¥×¸m§t5¢MCO2²Õ´°ö¾i½c¤¤, 2hr.
3.
±N¤Wz°ö¾i²G¥þ³¡Ë¤J40mlÂ÷¤ßºÞ,
Â÷¤ß5,000rpm, 5min, Ë¥h¤W²M, ¥[¤J§C±i·»²G(°t¤è¡G0.075M KCl)3ml,
¥R¥÷²V¦X, ¸m37¢J, 20min, ¦A¥[¤J©T©w²G(°t¤è¡G¥Ò¾J¡G¦B¾L»Ä¡×3¡G1)6ml,
½w½w¥R¥÷²V¦X, Â÷¤ß5,000rpm, 5min, Ë¥h¤W²M, ¦A¥[¤J5ml¤§©T©w²G,
½w½w¥R¥÷²V¦X, Â÷¤ß5,000rpm, 5min, Ë¥h¤W²M, ¦A¥[¤J5ml¤§©T©w²G,
½w½w¥R¥÷²V¦X, Â÷¤ß5,000rpm, 5min, Ë¥h¤W²M, ±N¥Õ¦å²y²G·»¦b1mlªº©T©w²G¤¤.
4.
±N²M¼ä¸ü¬Á¤ù¸m°sºë¤¤®ûªw,
¨ú¥X, ±N¤Wz¥Õ¦å²y²Gºw1~2ºw©ó¸ü¬Á¤ù¤W, ¨Ï¨ä·°®, ºw¤WGiemsa¬V¦â.
¦bÅã·LÃè¤U400xÄá¼v.
.¤Q¤C.°Êª«²Õ´°ö¾i§Þ³N
¦b°µ¥Õ¦å²y¬V¦âÅé®É¤w¤jP¤¶²Ð¹L¡G
1.
MEM°Êª«²Õ´°ö¾i²Gªº°t»s¡G¨Ì¼t°Ó»¡©ú¤§¿@«×,
±N¥i°ª·Å°ªÀ£®ø¬rªºMEM¥[¤JÀ³¦³Á`¶q90¢MªºdH2O,
µM«á°ª·Å°ªÀ£®ø¬r, «Ý§N«o«á¥[¤J10¢M¤û¦å²M, ¤Î³Ì²×¿@«×2¡Ñ10-3mMªºL-glutamine.
(Y«Yºû«ù²G, ¤û¦å²M¶q¥i°u´î).
2.
Animal cell lines¥i¦V·s¦Ë¹¬ì©Ò±ÄÁÊ.
3.
CO2°ö¾i½c¤º©³¼hÀ³¥[¤ô¤º¸m¤Ö¶qCuSO4¨¾Åð,
«OÀã.
4.
¸g±`¥H˸m¦¡Åã·LÃè¬d¬Ý²ÓMª¬ªp.
5.
·í²ÓM¾ÖÀ½,
§l°£°ö¾i²G, ¥H¥Í²z¹ÆQ¤ô¬~²ÓM2¦¸, (¥H25cm2°ö¾i¥×¨¥)¥[¤J1mlªº0.25¢Mtrypsin-EDTA²G,
¨Ï¤Ã§G15sec, §l°£, ¦Aµ¥1min, ¥[¤J2ml°ö¾i²G±N²ÓM·»¤J,
µM«á§l°£2/3, «O¯d1/3, ¦A¥[¤J4.3ml°ö¾i²G, §Y¥i.
6.
¹ï°Êª«²ÓMªº«O¦s,
¥i±N²ÓM¥Htrypsin-EDTA²G¨ú¥X, Â÷¤ß3,000rpm, 5min, Ë¥h¤W²M,
¥H¾A¶q¥Í²z¹ÆQ¤ô¬~²ÓM1¦¸(Â÷¤ß¬~), ±N²ÓM¥H³Ì²×¿@«×2¡Ñ107/ml·»©ó§t8¢MDMSOªº°ö¾i²G¤¤,«O¦s©ó¤p«¬½¦ºÞ¤¤,¸m4¢J,
1hr, 0¢J, 1hr, -20¢J, 1hr, ¦A¸m-70¢J, «O¦s.
.¤Q¤K.¨Ï¥ÎNucleoSpin RNA II ®M²ÕµÑ¨úRNA
ª`·N:
1.
¦b¨Ï¥Î¦¹®M²Õ®É,
¥²¶·À¹¤â®M, ¦]¨ä¤¤§tguanidinium thiocyanate.
2.
¦¹®M²Õ¤¤¤§°®¯»ª¬RNase-free
DNase I ¥²¶·¦s©ó-20¢J. ¦b¨Ï¥Î«e¥[¤J«ü©w¶q¤§RNase-free water,¦A¥H¨C100£gl«O¦s¦b¤pÂ÷¤ßºÞ¤¤,¦s©ó-20¢J.
¨BÆJ:
1.
¨ú106°Êª«²ÓM,
(©Î0.1g°Ê´Óª«²ÓM), ¥[¤J²GºA´á¤Î400£gl RA1²G¤Î4£gl£]-mercaptoethanol¥H¬ãÒÜ¿i¸H,
±N¸H²G§l¤JNucleoSpin Filter¤¤®M¤W¥~ºÞ, ¥H13,000rpmÂ÷¤ß1min.
2.
¦b«O¦s¤§²GÅ餤,
¥[¤J300£gl¤§99¢Methanol, vortex.
3.
±N2¤§²GÅé§l¤JNucleoSpin
RNA column¤¤, Â÷¤ß10,000rpm, 30¬í. ±N¥~ºÞ¥á±ó, ´«¤@·s¥~ºÞ,
¦AÂ÷¤ß13,000rpm, 1min.
4.
¦¹®É·Ç³ÆDNase
reaction mixture, ±N¤w²G¤Æ¤§DNase1 ¨ú10£gl, ¥[90£gl DNase 1 reaction
buffer, ±N¦¹²V¦X²G§l¤J3¤§¤ººÞ¤¤, ¸m«Ç·Å15min.
5.
§l500£gl RA2¤J3¤§¤ººÞ¤¤, Â÷¤ß30sec, 10,000rpm.
±N¤ººÞ¨ú¥X´«¸m¤J¥t¤@·s¥~ºÞ¤¤, §l600£gl RA3¤J3¤§¤ººÞ¤¤,
Â÷¤ß30sec, 10,000rpm, Ë¥h¥~ºÞ¤¤²GÅé, ¦A®M¦n¥~ºÞ, §l250£gl
RA3¤J3¤§¤ººÞ¤¤, Â÷¤ß2min, 13,000rpm, ¨Ï¤ººÞ§¹¥þ°®, (Y²G±±µÄ²¤ººÞ¤¤¤§½¤¼h,
¶·Ë¥h¦AÂ÷¤ß), ¦A±N¤ººÞ¨ú¥X¸m¤J¥t1nuclease-free·s¥~ºÞ¤¤.
6.
§l100£gl RNase-free water¤J¤ººÞ, Â÷¤ß13,000rpm, 1min,
©Ò±o§YRNA.
.¤Q¤E.¨Ï¥ÎNucleoTrap mRNA®M²Õ ¤ÀÂ÷mRNA
ª`·N:
1.
½w½Ä²G¤¤§tLiCl,
¥²À¹¤â®M.
2.
¦¹®M²Õ¤¤¤§oligo
dT²É¤l²G, ¨C20£gl¡×1mg, ¥i§lªþ5£ggªºmRNA.
¨BÆJ¡G
1.
Y«Y°®ÀꤧRNA,
«h¥[¤J1,000£gl RM1 binding buffer (¥i¾A¥Î©ó100~1,000£gg¤§RNA¶q), vortex¨ÏRNA¥R¤À²V¦X.
Y«Y²GºARNA(·»©ó¤ô¤¤, TE¤¤©Î¨ä¥L±`¥Î¤§½w½Ä²G¤¤§¡¾A¥Î), ¨ú200~500£gl¤§RNA²G, ¥[¤Jµ¥¶q¤§RM0 binding buffer,
¥R¤À²V¦X.
2.
±NOlig
dT²É¤l§¡¤Ã¤Æ(vortex), ¦b¨C§t100£gg¤§RNA¤¤¥[¤J15£glªºOlig dT²É¤l, ¥R¤À²V¦X,
¸m68¢J 5min(¨ÏRNAªº2¦¸µ²ºc¥h°£), ¦A¸m«Ç·Å10min, ¨C2min²V¦X´X¤U.
3.
Â÷¤ß15sec,
5,000rpm, ¦AÂ÷¤ß5min, 13,000rpm, §l°£¤W²M²G, ¥[¤J600£gl washing buffer RM2,
§l¤W§l¤U¥R¤À²V¦X.
4.
±NOlig
dT²É¤l²G§l¤JNucleoSpin microfilterÂ÷¤ß15sec, 5,000rpm, ¦AÂ÷¤ß2min,
10,000rpm. Ë¥h²GÅé.
5.
¥[¤J500£gl washing buffer RM3©óNucleoSpin microfilter¤¤,
¨Ã¤p¤ß¤£§Ë¯}NucleoSpin microfilter¦Ó±NOlig dT²É¤l¥R¤À²V¦X.
6.
Â÷¤ß15sec,
5,000rpm, ¦AÂ÷¤ß2min, 10,000rpm. Ë¥h²GÅé(¥h°£rRNA).
7.
¦A¥[¤J500£gl washing buffer RM3©óNucleoSpin microfilter¤¤,
¨Ã¤p¤ß¤£§Ë¯}NucleoSpin microfilter¦Ó±NOlig dT²É¤l¥R¤À²V¦X. Â÷¤ß15sec,
5,000rpm, ¦AÂ÷¤ß2min, 10,000rpm. Ë¥h²GÅé(¦A¦¸¥h°£rRNA).
8.
¦AÂ÷¤ß1min,
13,000rpm, ¥H°®ÀêNucleoSpin microfilter. ±NNucleoSpin microfilterºÞ¨ú¥X¸m©ó¥t1RNase-freeÂ÷¤ßºÞ¤¤.
9.
¹ï³Ìªì¥[¤J¨C10£glªºOlig
dT²É¤l²G, ¥[¤J20£gl¤w¥[¼ö¦Ü68¢JªºRNase-free
water, §l¤W§l¤U, ¥R¤À²V¦X, ¸m68¢J, 7min, Â÷¤ß1min, 13,000rpm.
©Ò±o²GÅé§YmRNA. ¥i¦A§l¤Jì³Ìªì¥[¤J¨C10£glªºOlig dT²É¤l²G,
¥[¤J10£gl¤w¥[¼ö¦Ü68¢JªºRNase-free
water, §l¤W§l¤U, ¥R¤À²V¦X, ¸m68¢J, 7min, Â÷¤ß1min, 13,000rpm. ¦¹²Ä2¦¸©Ò±o¤§mRNA¿@«×±N¸û§C(¬ù²Ä1¦¸ªº10~20¢M).
¥i¤À§O«O¦s¦b-70¢J.
.¤G¤Q.±NmRNA»s¬°cDNAªº¤èªk
1.
·Ç³Æ2.5mMªºdNTPmix»P5x
Reverse Transcriptase (RT) buffer(§t250mM Tris-Cl, pH8.3, 375mM KCl, 15mM MgCl2),
RT 200£gg/£gl, 0.1M DTT(³q±`ÀH¶RRT¨Ãªþ),
10x Taq polymerase buffer.
2.
¥HPCR¥Î0.5mlÂ÷¤ßºÞ,
·Ç³ÆmRNA, (³Ì¦n1£gg/£gl), 10£gl, ¥[¤J1£gl(0.1£gg/£gl)¤urandom primer(6-mer), ¸m70¢J,
2min.
3.
¥[¤J5x
RT buffer 5£gl, 0.1M DTT
3.5£gl, dNTPmix 5£gl, RT 1£gl, ¸m37¢J1hr.
4.
¸m70¢J,
5min, ¨ÏRT¯}Ãa.
5.
¨ú2.5£gl¥X¨Ó¥Î¸m¤J¥t1PCR¥Î0.5mlÂ÷¤ßºÞ, ¥[¤J8£gl dNTPmix, 10£gl Taq polymerase buffer,
¥[¤J°w¹ï¦¹°ò¦]³]pªº2Óprimers¦U1£gl, ¥[¤J1£gl Taq polymerase,
¦A¥[¤JdH2O 77£gl, ¦A¥[50£gl
mineral oil, °õ¦æPCR, 94¢J,
5min, 94¢J, 1min, 55¢J, 1min, 72¢J, 2min, 30cycles, §Y¦¨.
©Ò±o¦¨«~¥i¥H¹qªa¯Â¤Æ.
§÷
®Æ¡G
¹qªa½w½Ä²G(¥i¥ÎTAE©ÎTBE),
°t¤è¦p¤U¡G
TAE-Àx¦s²G¡G50X,
¨C¤½¤É¤¤§t¡G242g Tris. Base
57.1ml
glacial acetic acid
37.2g Na2EDTA. 2H2O
pH8.5
¨Ï¥Î²G¡G0.04M
Tris. Acetate
0.002M EDTA
TBE-Àx¦s²G¡G10X,
¨C¤½¤É¤¤§t¡G108g Tris. Base
55g boric acid
40ml
0.5M EDTA
pH8.0
¨Ï¥Î²G¡G0.089M
Tris. Base
0.089M boric acid
Ethidium
bromide solution
[°t¤è]1000XÀx¦s²G(0.5mg/ml)
50mg
ethidium bromide
100ml
H2O
«O¦s¦b4¢J,
¤£³z¥ú²~¤¤.
¨Ï¥Î²G¡G0.5£gg/ml
±NÀx¦s²G¥H1¡G1000¿µ}ÄÀ§@¥Î
Agarose
10X
loading buffer
[°t¤è]
20¢MFicoll 400
0.1M
Na2EDTA, pH8
0.1¢M
Sodium dodecyl sulfate
0.25¢M
Bromphenol blue
0.25¢M
Xylene Cyanol
¨ä¤¤Xylene Cyanol ¦b¹qªa®É, ¤ñBromphenol
blue¶]±oºC50¢M¥ª¥k.
DNA¤À¤l¶qmarker(¥i¨Ì¹qªa¤§DNA¤À¤l¤j¤p¿ï¾Ü¾A·í¤§marker)
¹qªa³]³Æ¤Î¨Ñ¹q³]³Æ
µµ¥~½u¤â´£¥ú·½,
µµ¥~½u¥ú·½¥¥x, ©ç¥ß±o¬Û¾÷(±M¨Ñ·Ó¹qªaµ²ªG¥Î)¤Î¾ï¦âÂo¥úÃè.
¤è
ªk¡G
1.
¥HTAE©ÎTBE·Ç³Æ¹qªa½¦,
¦b½¦¤º¥[¤Jethidium bromide(³Ì²×¿@«×0.5£gg/ml)ªa½¦¤¤agaroseªº¦¨¤À¨ÌDNAªº¤j¤p¦Ó¤£¦P,
¥Hª½½u«¬DNA¬°¨Ò¥i°Ñ¦Ò¤Uªí¡G
|
Agaroseªº¦¨¤À¶q |
DNA(ª½½u«¬)ªø«×Kb |
|
0.5 |
1~30 |
|
0.7 |
0.8~12 |
|
1.0 |
0.5~10 |
|
1.2 |
0.4~7 |
|
1.5 |
0.2~3 |
©Ò˪ºªa½¦«p«×¬ù¦b0.5~1cm¤§¶¡,
ªa½¦¥i¦b·LªiÄl¤¤¥[¼ö¿Ä¤Æ,
«Ý¨ä§N«o¦Ü¤âIJ¤´·P¿S¦ý¤£¹L¿Sªºµ{«×, §Y¥iˤJªa½¦½L¤¤,
´¡¦nªa½¦½L®Þ, «Ý¨ä§N«o, ¦A©â¥X®Þ¤l.
2.
±Nªa½¦©ñ¤J¹qªa¸Ë¸m¤¤,
¥[¤J¾A¶q¹qªa½w½Ä²G, (²G±¤j¬ù°ª¥X½¦±1mm§Y¥i).
3.
±NDNA¼Ë¥»¾A¶q¥[¤J¾A¶q10X
loading buffer«á, ¥HmicropipetÂà¤J½¦¤Õ¤¤.
4.
³q¤W¹q¬y,
¹q¬y¥Hªa½¦¤§ªø«×¨Ccm 10V¬°ì«h.
5.
·íloading
buffer¤§ÂŦⲾ¦Ü¬Û·í¦ì¸m«á, §Y¥i±N¹q¬yÃö±¼, Àˬd¹qªaµ²ªG,
©Î±Nµ²ªGÄá¼v. ¹qªaµ²ªG¥i¥H¤â´£¦¡µµ¥~½u¥ú·½·Ó®gÆ[¹î,
¥ç¥i¥Î¦³¸n¦¡©ç¥ß±o¬Û¾÷(¥²¶·¥[¸Ë¾ï¦âÂo¥úÃè),
¦bµµ¥~½u¥ú·½¥¥x¤WÄá¼v. ©³¤ù¨Ï¥ÎPolaroid½s¸¹667(ASA3000).
¥»¹êÅç±Ä¥ÎGENECLEAN III Kit,¦¹®M¹ê²ß§÷, «O¦s©ó«Ç·Å, ¬ù¦³80¢MªºDNA¦^¦¬²v.
§÷
®Æ¡G
NaI²G
New
Wash¿@ÁY²G
TBE
modifier
GCIII
Elution Solution
¨ä¤¤NaI¬°6M
sodium iodide solution
TBE
modifier¬O¥Î©óªa½¦, Y¬O¥HTBE»PAgarose»s¦¨, «h¥[¤Á¤Uªa½¦Åé¿n1/2¤§TBE
modifier¤Î4.5¿Åé¿nªºNaI.
EZ-GLASSMILK¬O·»©ódH2Oªº¯BÄa²G,
¨I¾ý¤U¨Ó, À³¨I¾ý»P¤ô¦U¥b, Y¤ô¤À»]´², ¥i¥[¤J¾A·ídH2O.
New
Wash solution¤§°t¸m¡G¥Î14ml¤§¿@ÁY²G, ¥[280ml dH2O, ¦b»P310ml
100¢Methanol(©Î95¢Methanol)²V¦X. ¥Î¦¹®M¹ê²ß§÷±NDNA´åªa½¦¤¤´£¥X«á,
¤£§tethidium bromide.
¦]¬°TBE¹ïDNAÖߪþ¦bEZ-GLASSMILK¤W¦³¼vÅT,
¬G¦b±Nªa½¦¥[¤JNaI¿Ä¤Æ«e¥ý¥[¤JTBE modifier¥H¥h°£¦¹¼vÅT(°§CpH).
¤è
ªk¡G
1.
¥H¤p¤M¤ù±N§tDNAªºªa½¦¤Á¥X(¦bµµ¥~½u¥¥x¤W°õ¦æ),
¯¯«¶q, ¥H«¶q¦ôºâÅé¿n, ¤j¬ù1g¬°1ml, ±N¦¹¤p¶ôªa½¦©ñ¤J1.5mlÂ÷¤ßºÞ¤¤(¤Á¶ô³Ì¦n¦b0.4g¥H¤U).
2.
Y¹qªa¬O¦bTAE¤¤°õ¦æªÌ,
«h¤£¥Î¥[TBE modifier, ª½±µ¥[¤J3¿Åé¾÷ªºNaI²G, Y¹qªa¦bTBE¤¤°õ¦æªÌ,
«h¥ý¥[¤J1/2¿Åé¿n¤§NaI²G. ±NÂ÷¤ßºÞ¸m55¢J¤ô¯D¾¹¤¤,
¨C¹j¤@¤ÀÄÁ¨ú¥X²V¦X¤@¤U, ¦A©ñ¤J, ¬ù5¤ÀÄÁªa½¦¥i§¹¥þ¿Ä¤Æ.
[¦¹®M¹ê²ß§÷¤]¥i¥Î¦b¬°´£¯ÂDNA, §Y±NDNA²G¤¤ª½±µ¥[¤J3¿Åé¿nªºNaI²G,
µM«á¶i¦æ¤U¦C¨BÆJ].
1.
¥[¤J¾A¶q¤§EZ-GLASSMILK,
¥[¤J¤§¶q¥H¹w¦ôDNA§t¶q¦³Ãö, §Y¨C1£gg DNAn¥[2£gl, ¦ý³Ìªì¦Ü¤Ön¥[5£gl, ¥ç§YYDNA§t¶q¤Ö5£gg, ¥ç¦Ü¤Ön¥[5£gl¡FY¦h©ó5£gg, ¦A¨C¦h1£gg, ¥[2£gl.
2.
¥R¤À²V¦X,
¨Ã¸m«Ç·Å5min, ¨C1¤ÀÄÁ²V¦X¤@¤U.
3.
Â÷¤ß2,500rpm,
10sec.
4.
§l°£¤W²M²G,
¥[¤J400£gl¤§New Wsah²G, ¥R¤À²V¦X, ¦AÂ÷¤ß2,500rpm, 10sec,
§l°£¤W²M, ¦p¦¹¦A«½Æ2¦¸(¦@¬~3¦¸), §l°£¤W²M.
5.
¥[¤J20£gl¤§GCIII
Elution Solution, ¥R¤À²V¦X, Â÷¤ß3,000rpm, 30sec, §l¨ú¤W²M,
§Y¬°©Òn¤§DNA.
§÷
®Æ¡G
dH2O
10X
restriction endonuclease buffer (±ÄÁʨî酶®É¦P®É¦V¼t°Ó¯Á¨ú)
Gel
loading buffer (³q±`¥çÀH¨î酶¦P®ÉªþÃØ)
¤è
ªk¡G
1.
±N¤U¦C§÷®Æ¥Hmicropipettor§l¨ú©ñ¤J¤@Ó1.5mlªºÂ÷¤ßºÞ¤¤¡G
Xul DNA (DNAªº¶qÀ³¦A0.1~0.4£gg¤§¶¡, ·»©ódH2O©ÎTE¤¤)
2£gl 10X
restriction buffer
18-X£gl dH2O
2.
¥[¤Jrestriction endonuclease(¨C£gg DNA 1~5 unit, ¨Cunit ªí¥Ü¨î酶¦A1hr¤¤¥i§¹¥þ¤Á³Î1£g DNAªº¨î酶¶q), ¦Ü37¢J, 1hr.
3.
¥[¤J5£gl
gel loading buffer.
4.
¨ÌDNA¹qªaµ{§Ç¥H¹qªaÀË´úµ²ªG.
Y¬ODNAn¥H¤@Ó¥H¤Wªº酶¤Á³Î,
¥iµø¦U酶±ø¥ó, Y±ø¥ó¬ÛY,
¥i¦P®É¥[¤J¡FY±ø¥ó¤£¦P¦p·Å«×, ÆQ¤Àµ¥n¨D. ¥i¤À§O¤Á³Î,
¥ý¤Á³Î·Å«×n¨D§Cªº, ÆQ¤Àn¨D§Cªº, ¦A¥[¤JÆQ¤À(¦p1£glªº1M NaCl), ©Î´£°ª·Å«×.
Y¬O¥Î¦P¤@Ó酶¦P®É¤Á³Î³\¦hDNA¼Ð¥»,
¥i¥ý±N10X restriction endonuclease buffer, dH2O, restriction engonuclease¸m¦b¥t¤@ÓÂ÷¤ßºÞ¤¤¨ÌÁ`»Ýn¶q²V¦X¦n,
¦A¤À§O§l¤J¤£¦PDNA¼Ð¥»ºÞ¤¤, «Ý¤Á³Î®É¶¡¨ì, ¦A¥[¤Jgel loading
buffer, ¦A¶i¦æ¹qªa.
¤U¦C¬°±`¥Î¨î酶»P¨ä¤Á³Î±Æ§Ç, ¡ôªí¥Ü¤Á³Î¦ì¸m¡G
|
酶
¦W ºÙ |
¤Á³Î¤ù¬q»P¦ì¸m |
ªþ
µù |
|
Asp
I |
5'GACN¡õNNGTC3' |
(N¥Nªí¥i¬°A,
T, G, C,¤¤¥ô¤@) |
|
Bam
HI |
G¡õGATCC |
(»PBst
I¦P) |
|
EcoR
I |
G¡õAATTC |
|
|
Hind
III |
A¡õAGCTT |
(»PHinc
II¦P) |
|
Hpa
I |
GTT¡õAAC |
|
|
Ksp
I |
CCGC¡õGG |
(»PMra
I, Sac II, Sst I¦P) |
|
Pac
I |
TTAAT¡õG |
|
|
Pst
I |
CTGCA¡õG |
|
|
Sac
I |
GAGCT¡õC |
(»PSst
I ¦P) |
|
Taf
I |
T.¡õCGA |
(»PTeh
HB 81¦P) |
¥H¤Wªº¤Á³Î¦ì¸m§¡¬°ÂùªÑ,
¬GÂùªÑªº¤Á³Î¦ì¸m¥HBam HI¬°¨Ò¬°¡G
5'G¡õGATCC3'
3'C
CTAG¡õG5'
¨ä¾l§¡Ãþ¦¹.
酶À³«O¦s¦b-20¢J§NÂd¤¤,
¨Ï¥Î®É¨ú¥X©ñ¦b0¢J¦B¤W, 酶ªº»ù®æ©ù¶Q, ©y¬Ã±¤¨Ï¥Î.
¦UºØ酶§¡¦³¨ä¯S§Oªº½w½Ä²G.
³q±`§¡¥i¦b±ÄÁʮɦV¼t°Ó¯Á¨ú.
The Klenow
fragment¡G¬OE.Coli DNA PolymeraseI¾aCºÝªº³¡¥÷¡A¬°§R¥h¥ÑNH2ºÝªº323ÓÓi°ò»Ä¦Ó¦¨¡A¨ã¦³DNA
Polymerase»P3'¡÷5'exonucleaseªº¥\¯à. ¥HKlenow fragment¨Ó±N§t¿Ã¥ú¼Ð©wªºd
NTP©Î©ñ®g©Ê¼Ð©wªºd NTP¥[©óDNA¤ù¬q§ÀºÝ, ¥i±N¬ù0.1~4£gg¥Ñ¹qªa¤¤´£¯ÂªºDNA, ¥[¤W¿Ã¥ú¼Ð©wªºd NTP,
¦A¥[¤W¥¼¼Ð©wªº3 d NTPs, ¦A¥[¤W1UªºKlenow fragment, ¦A¥[¤J¾A¶qbuffer,
¸m30¢J, 20min§Y¥i(¨ä¤¤d NTPªº¿@«×¦b0.5mM).
¦¹ì²z¬O§Q¥Î¨î酶¤Á³Î«á¦A¸g¹qªa´£¯ÂªºDNA,
¦b¤GºÝ§¡¦³ ----____³æªÑ³¡¤À, Klenow fragment·|±Nd NTP¥[©ó³æªÑ³B,
¦¹®É»Ýª`·Nªº¬O©Ò¯Êªº³æªÑY¥¿¦nµL¥i°t¼Ð©wd NTPªº®Ö¥Ì»Ä«hµLªk¼Ð©w,
¬GÀ³ª`·N. ¦p¥HBan HI¤Á³Îªº·|¦³GATC±Æ§Ç, Y¥HEco RI¤Á³Îªº«h·|¦³AATT±Æ§Ç,
¦¹®ÉY¥H¦³¼Ð©wªºGTP©ÎCTP¨Ó¼Ð©w«hµL®Ä.
¥ç¥i±Ä¥ÎRandom
Oligonucleotide-Primed synthesis¤èªk¨Ó¼Ð©wDNA, ¨äì²z¬°¡G±NDNA¥H¬Y¤@¨î酶¤Á³Î,
¦A¹qªa, ¨ú¥X©Ò»ÝªºDNA¤ù¬q, ¥[¼ö¨Ï¦¹ÂùªÑDNA¤À¬°³æªÑ, ¦A±NRandom
Oligonucleotide(³q±`¬°¤»Ónucleotides)±µ¤W¥h, ¦A©ñ¤Jd NTPs§YKlenow
frament, ¦p¦¹, «hDNA¤ù¬q´N·|³Q¼Ð©w¤F.
¤è
ªk¡G
1.
¦b¤@Ó¤p«¬Â÷¤ßºÞ¤¤¥[¤J2.5£gl¤§0.5mM 3dCTPs.
2.
¦A¥[¤J10X¤§Klenow
fragment buffer, 2.5£gl.
3.
¥[¤J±ý¼Ð©w¤§¦³¼Ð©wdNTP,
1£gl.
4.
¦A¥[¤J1£gl¤§Klenow
fragment.
5.
¦A¥H¥t¤@¤äÂ÷¤ßºÞ,
¥[¤J¬ù0.03~0.1£ggªºDNA(·Q³Q¼Ð©wªºDNA), ¤ÎRandom hexanucleotide(1£gg), ¦A¥[¤JT.E. buffer¨ÏÁ`Åé¾÷¬°18£gl,
±N¦¹Â÷¤ßºÞ¸mªm¤ô¤¤3min, ¦A¨ú¥X©ñ¦B¤W.
6.
±N¤G¤äÂ÷¤ßºÞª«²V¦X,
¸m«Ç·Å, 3hr, ¤ÏÀ³§Y§¹¦¨.
Taq DNA Polymerase¤§¨Ï¥Î¡G
¦¹酶«Y¥ÑThermus
aquaticusµß©Ò¤ÀÂ÷¥X¨Ó,
¥¦ªº³Ì¦³®Ä·Å«×¬O¦b75~80¢J, ¥¦¦h³Q¥Î©óPolymerase Chain
Reaction(PCR). ¨ä¨Ï¥Î¤èªk¦b¤¶²ÐPCR®É¦A¦æ¤¶²Ð.
RNase¥ç¦³¥Ñ¤£¦P¨Ó·½¤ÀÂ÷¥X¨ÓªÌ,
©Ò¤Á³ÎRNAªº¦ì¸m¥ç¤£¦P, ¦ý¤@¯ëRNase§¡¯à¦b¦hºØ¤ÏÀ³±¡ªp¤U²£¥Í§@¥Î,
¥B¨Ï¥Î«áYn°£¥h¥¦, ³q±`n¥[¤JProteinase K, ¦A¥HPhenol
extractions¤Îethanol precipitation³B²z.
DNA ligases¡G
¥Î¥H±µ¦X³æªÑ¦³¯Ê¤fªºDNA©ÎÂùªÑ¥i¥æ¤e°t¦XªºDNA(§Y¥H¨î酶¤Á³Î©Ò§Î¦¨ªº ----____
¥æ¤e¤ù¬q. ®É¤U¨Ï¥Îªºligase, nATP, E.Coli ligasenNAD¬°¯à·½.
¨Ï¥Î¤èªk¡G
1.
¦b·L¶qÂ÷¤ßºÞ¤¤¥[¤Jligase½w½Ä²G,¦A¥[¤J0.5mM
ATP, 1£gg DNA(§Y©Ò»Ý±µ¦XªºDNA),
¦A¥[¤J1£gªºT4
ligase, ¸m15¢J, 2hr, ¥i¦¨.
2.
Y«Y¤G¬q¶wºÝDNA±µ¦X(§YµL¥æ¤e¤ù¬q¤§DNA),
«h»Ý10¿¥H¤Wªº酶¤è¯à¹F¦¨.
¦³¬ã¨sÅã¥Ü¥[¤J§Y¬°¶qªºPEG8000¥i§Uligaseªº¥\¯à.
¹B¥Îligaseºc«Ø¶ù±µDNA¤À¤l¡G
1.
¦A±N·Qºc«ØªºDNA¤ù¬q¸g¹qªa¥®´£¯Â¤§«á,
¥H¤Uªk¶i¦æ¡G
2.
¨ú0.1¦Ü5£gg·Q±µ¦Xºc«ØªºDNA©ñ¤J·L¶qÂ÷¤ßºÞ¤¤(Åé¿n¥H9£gl¬°·Ç), ¦A¥[¤J10£gl¤§2X
ligase buffer, ¦A¥[¤J1£gl¤§10mM ATP, ¦A¥[¤J20¦Ü500£gªºT4
DNA ligase(¥H¦³¥æ¤e°t¹ïªºDNA¬°·Ç).
3.
¸m15¢J, 3hr, ©Î¹j©], ¥i¦¨.
4.
±N¦¹±µ¦X¤§¶ù±µ´C¤¶, ¥H°ò¦]Âà´Ó¤è¦¡,
´Ó¤JE.Coli±J¥D, ¨ÃÀˬdµ²ªG, ¨Ìmarkerªí²{±¡§Î¥iª¾¦³µL¥¿½Tªºµ²ªG,
Y¦³, «h±N§t¦¹¥¿½T¶ù±µ´C¤¶ªºE.Coli¥[¥H°ö¾i,
¦A¥H´£¯Â½èÅé¤è¦¡Àò¨ú¤j¶q©Ònªº¶ù±µ´C¤¶.
2X T4 DNA ligase buffer¤§°t¤è¬°¡G
100mM Tris.Cl, pH7.5
20Mm
MgCl2
20Mm
DTT(dithiothreitol¦¹ª«¥²¶·§Ná«O¦s)
¦bºc«Ø¶ù±µ´C¤¶®É,
¥²¶·¦Ò¼{¨ì¥¦n¯à¦b±J¥D¤¤¯à¦Û¦æ½Æ»s,
¥B¯à±N©Ònªº°ò¦]ªí²{¥X¨Ó, ¦Ó¥BÁÙ¯à¥[¤Wmarker, ¥H«K¥Ñmarker¤§¦³µL¨ÓÀË´úºc«Ø¤§¦¨¥\»P§_.
¦b¨Ï¥Îligase®É, ±`·|¦³¦UºØ¾÷²vªºµ²¦X, ¦Ó²£¥Í«D©Ònªºµ²ªG,¥ç¦³¦h¬qµ²¦XªÌ¡A
¦ý¦]¬Ò»P©ÎµM²v¦³Ãö, ²z½×¤W¤´·|¥X²{Y¤z©Ònªºµ²ªG.
¥»¹êÅç¶È¥H§¡¸g¨î酶¤Á³Î§Î¦¨¦³¥æ¤e¯Ê¤f¤§ÂùªÑDNA¦æ¤§.
±N¶ù±µ´C¤¶»P©Ònºc«Ø¶i¤J´C¤¶ªºDNA¾A¶q²V¦X, ¥[¤J1£gªºT4
DNA ligase, ¦A¥[¤J¾A¶qligase buffer¤Î¾A¶qBSA, ¸m25¢J, 2hr,
¦¹ºØ«Øºc¤è¦¡·|²£¥Í¦]ÀH¾÷µ²¦Xªº¦UºØ¤£¦P«²ÕDNA,
¥ç¦³¦h©ó¤@¬q¥H¤W©ÒnªºDNA¦P®Éºc«Ø¤J¦P¤@´C¤¶ªÌ.
¦A¥H¹qªa¤ÀÂ÷¤§. ¦A±Nºc«Ø¦nªº´C¤¶Âà´Ó¤J±J¥D²ÓM,
¨Ã¨Ï¤§¼W´Þ, ¦A±N§t«²ÕDNAªº²ÓM«O¦s©ó¥Ìªo²G¤¤, «O¦s¦b-70¢J.

Y±ýÀË´ú©ÒnªºDNA¬O§_¤w¶i¤J¬Y¤@±J¥D²ÓM¤¤,
¥i±N¦¹±J¥D²Óµß¥H¶î¥½Lªkªø¦b¥½L¤W¦A¥HnylonÂo¯È»\¤W,
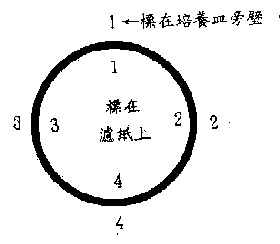
±Nµß¸s¼Ò¦L¦bnylonÂo¯È¤W, ¦A±N¦¹Âo¯È¥H¹]µ§°µ¤W¥¿±(¦³µß¸s)¤§°O¸¹,
¨Ã¥H¦y°w¦bÂo¯È¤W¨ë¥|³B¤p¤Õ, ¨Ã»P°ö¾i¥×¤Wªº¬Û¹ï¦ì¸m¼Ð¦n,
¦p¡G
¦A±N¦¹nylonÂo¯È©ñ¦b¤@±i§lº¡0.5M NaOHªºÂo¯È(´¶³qÂo¯È)¤W,
5min, ¦A±NnylonÂo¯È¦b²¾©ñ¦b¥t¤@±i§lº¡1M Tris. Cl, pH7.5ªº´¶³qÂo¯È¤W,
5min, ¦A±NnylonÂo¯È²¾©ñ¦b¥t¤@±i§lº¡0.5M Tris. Cl, pH7.5/1.2M NaClªº´¶³qÂo¯È¤W,
5min, ±µ¤U¨Ó±N¦¹nylonÂo¯È¸m¤w¦Û°Ê³]©w¤§UV Crosslinker¤¤, ¨ÏDNA©T©w,
¦A¶i¦æ«n¤è¦¡Âø¥æ, ¥HDNA±´°w§ä¥X©ÒnDNAªºµß¸s¦ì¸m,
«h¥i¦bì©l°ö¾i¥×¤W§ä¥X©Ònªºµß¸s. ¦¹nylon
Âo¯È¥i¥ý¥H¾Tºä¯È¥]¦n°ª·Å°ªÀ£®ø¬r¥H¹FµLµßª¬ºA.
¦b¦L¨úµß¸s®É, ¤ÅÅýnylonÂo¯È»P¥½L¶¡¦³ªÅ»Ø.
DNA¤ùÂ_¸g¹qªa«á, ¦A±NÂùªÑ¤ÀÂ÷¬°³æªÑ, µM«á±N¦¹³æªÑDNAÂಾ¦Ünylon½¤¤W,
¸g¹L«e³B²zµ{§Ç, ¥HÁקKÂø½è¼vÅTµ²ªG, ¦A±N¨ã¦³¿Ã¥ú¼Ð»xªºDNA±´°w»P¦¹³æªÑDNAÂø¥æ,
¤§«á±N¥¼µ²¦Xªº¦h¾l³æªÑDNA¬~¥h, ¦A±Nnylon½¤©ñ¤JX¥ú¤ù¥d§¨¤¤,
«ÝÃn¥ú§¹¥þ«á, ±NX¥ú¤ù¨R¥X, ¥HÀ˵øµ²ªG.
§÷
®Æ¡G
±ýÀË´ú¤§DNA(10£gg¥ª¥k)
¹qªa³]³Æ
DNA
marker
ª½¤Ø
0.2N
HCl
nylon½¤
Denaturation
solution
[°t¤è]1¤½¤ÉdH2O¤¤§t87.75g NaCl, 20.0g NaOH«O¦s©ó«Ç·Å
Naturation
Solution
[°t¤è]1.5M NaCl, 0.5M Tris.Cl pH7.2, 0.001M EDTA
20X
SSC
[°t¤è]¨C¤½¤É§t175g
NaCl, 88g Na3.Citrate.2H2O¥H1M HCl±NpH½Õ¾ã¦Ü7.0
³z©ú¶ì½¦½¤
Vaccum
blotter
¤j±iÂo¯È
0.4M
NaOH²G
SDS/Prohybridization
solution
[°t¤è]¨C500ml¤¤§t¡G
12.5ml¤§1M
KPO4, pH7.4
125m¤§20X
SSC
25ml¤§100X Denhardt`s solution
-°t¤è-¨C500ml¤¤§t¡G
10g
Ficoll 400
10g
Polyvinylpyrrolidone
10g
BSA«O¦s¦b-20¢J
©Î¥H30g²æ¯×¤û¥¤¯»·»©ó500ml
dH2O¤¤¨ú¥N
5ml¤§5mg/ml
salmon sperm DNA
250ml¤§100¢Mformamide
82.5ml¤§dH2O
¦A¥[¤J1¢M(w/v)¤§SDS«O¦s¦b-20¢J
SDS/hybridization
solution
[°t¤è]»PSDS/Prehybridization
solution¬Û¦ü, °£¤£¥[¤ô¥~, ¥[¤J50gªºdxtran sulfate<¤À¤l¶q500,000>,
µM«áÅÍ©Õ¾ã©], ²Ä¤G¤Ñ¦b¤ô¨Ï¾ãÓÅé¿n¦¨¬°500ml, «O¦s¦b-20¢J.
µµ¥~½uDNA©w¦X»ö
«Ê³U¾÷
¶ì½¦³U
¥H¿Ã¥ú¼Ð©w¤§±´°wDNA(¦¹¤@³¡¥÷¤§»s§@¥t¥~»¡©ú)
X¥ú¤ù
X¥ú¤ù¥d§¨
·t©Ð³]³Æ(¸ËX¥ú¤ù¤Î¨R¤ù¥Î)
¤è
ªk¡G
1.
¥ý±N±ýÀË´ú¤§DNA¤ÎDNA
marker¨Ì¤@¯ë¹qªa§Þ³N°õ¦æ¹qªa.
2.
±N¹qªa½¦¨ú¥X·Ó¬Û(¦b©ç·Ó®É¤@§âª½¤Ø©ñ¦bªa½¦®Ç,
¥H½T©w¦UDNA¤ù¬q¤§¦ì¸m¥H«K¤ñ¸û¤À¤l¶q).
3.
±N¹qªa½¦©ñ¤J¨Ì§t500ml
0.2N HClªº½L¤¤, ½w½w·n°Ê¦¹½L10min.
4.
Ë¥hHCl²G,
¥[¤JdH2O²M¬~ªa½¦¤T¦¸. ¦¹®Éloading dye¤¤ªºbromphenol blue¥ÑÂÅÅܶÀ,
Ë¥hdH2O.
5.
ˤJ500ml
denaturation solution, ½w½w·n°Ê½L¤l, 15min«á, Ë¥h²GÅé¦A«½Æ¤@¦¸,
¦¹®Ébromphenol blueÃC¦â¤S«ì´_¬°ÂŦâ, Åã¥ÜDNAÂùªÑ¥H¤ÀÂ÷¬°³æªÑ,
Ë¥h²GÅé.
6.
¥[¤J500ml
denaturation solution, ·n°Ê½L¤l30¤ÀÄÁ.
7.
¥H§Q°Å°Å¤U¤@¶ô¤ñªa½¦¦UÃ䧡¤p3mm¤§nylon½¤,
¦Ü¤@½L¤¤§t20X SSC²G, ²G¶q¤w¯à¾B»\¦¹½¤¬°«×, 5min(³B²znylon½¤®É¥²¶·À¹¤â®M¾Þ§@,
¥H§K¼vÅT¹êÅçµ²ªG, ¦]¦¹½¤·¥¬°±Ó·P).
8.
¥t°Å¤@±iÂo¯È»Pnylon½¤¦P¤j¤p,
¥ç®û¤J20X SSC²G¤¤.
9.
¨ÌVaccum
blotter¸Ë¸m±Nnylon½¤©ñ¦bÂo¯È¤W, ¦A©ñ¦b¦h¤Õ½L¤W, ¦A©ñ¦bblotter¥DÅé¥W¥Yª¬¥½L¤W,
¦bnylon½¤¤W«h©ñ¤W³n¶ì½¦¹Ô¤ù, ¦¹¹Ô¤ù¤§¤W©ñªa½¦,
¦³¤Õªº±¦V¤W, ªa½¦©³ÃºÃ䧡¤ñ¦¹¹Ô¤ù¤§¤Á³Î±n¤j¦Ü¤Ö5mm,
¦A»\¤Wblotterªº»\®Ø.(Yªa½¦»Pnylon½¤¤§¶¡¦³¥ô¦ó®ðªw¦s¦b,
¥i¥H¬Á¼þ§lºÞ¥¥±À¹Lªa½¦±, ¨Ï®ðªw±À¥X,
¦Ü§¹¥þµL®ðªw¬°¤î).
10.¥´¶}©â¾¹¶}Ãö,
½Õ¾ã§l¤O¦Ü5 inches¤ô»È¬W°ª.
11.¦bblotter»\®Ø¤¤Ë¤J1,500ml¤§0.4M
NaOH²G,
Àˬdªa½¦»P¹Ô¤ù¤§±µ¦X¬O§_ºò±K¡F¨ÃÀˬd¯uªÅ§l¤O¬O§_ºû«ù5
inches Hg, °µ¥²n¤§½Õ¾ã.
12.ÅýDNA´åªa½¦¤¤Âಾ¦Ünylon½¤¤W,
90¤ÀÄÁ, Ãö±¼¶}Ãö.
13.±N¸Ë¸mÃP¶},
¨ú¥Xªa½¦, ¦bµµ¥~½u¤UÀˬd¬O§_¦³µLDNA¦s¯d.(¥²n®É¥i¦A¥H1.0£gg/ml¿@«×ªºethidium bromide¬V¦â¤@¦¸¦bÀˬd).
14.±Nnylon½¤¨ú¥X,©ñ¦b2X
SSC¤¤2¤ÀÄÁ¦A¨ú¥X, ¦¹®É¥H¹]µ§¦bnylon½¤¤W°µ°O¸¹¥H¿ë»{¦³DNAªº±.
15.±Nnylon½¤¥H³z©ú½¦½¤¥]¦n,
¦³DNAªº±¦V¤W, ¦Ü©óµµ¥~½uDNA©w¦X»ö¤¤·Ó®g120,000micro joules,
5minµµ¥~½u, ¦¹®ÉDNA¤w©w¦X¦b½¤¤W, ¨ú¥Xnylon½¤.
16.±Nnylon½¤©ñ¤J«Ê³¬ªº¶ì½¦³U¤¤,
¨Ã¦b³U¤¤¥[¤J10ml SDS/Prehybridization²G, ¦Ü65¢J, 1hr«á,
°Å¶}³U¨¤¤@¤p¤f, Ë¥X²GÅé.
17.±N·Ç³Æ¦nªº±a¿Ã¥ú¤§DNA±´°w©ñ¤p«¬Â÷¤ßºÞ¤¤,
¦bªm¤ô¤¤¸m5¤ÀÄÁ, ¦A±N¤§¥[¤J10ml¤§SDS/hybridization²G¤¤,
¥R¤À²V¦X, ¦Aª`¤J³U¤¤, ¦A±N³U¨¤«Ê¤f, ¸m65¢J, ¹L©].
18.²Ä¤G¤Ñ,
±N³U°Å¶}, ¨ú¥Xnylon½¤,
¥ý¥H
2X SSC/0.1¢MSDS¬~ 5min, «Ç·Å¡F
¦A¥H
2X SSC/0.1¢MSDS¬~15min, «Ç·Å¡F
¦A¥H0.5X
SSC/0.1¢MSDS¬~15min, «Ç·Å¡F
¦A¥H0.1X
SSC/0.1¢MSDS¬~15min, «Ç·Å¡F
¦A¥H0.1X
SSC/0.1¢MSDS¬~30min, 65¢J.
19.±Nnylon½¤¥Ñ¥]½¤¤¤¨ú¥X,
¦b·t©Ð¤¤±Nnylon½¤»PX¥ú¤ù©ñ¤JX¥ú¤ù§¨¤¤, 2¤Ñ, ¦³DNAªº±»PX¥ú¤ù¬Û¦V.
20.¦b·t©Ð¤¤,
¨ú¥XX¥ú¤ù, ¨R¥X, À˵øµ²ªG.
¦b¥¿±`±¡ªp¤U, ¦b10£ggªº÷¨ÅÃþDNA¤¤,
¥i°»´ú¥X10pq(1pq¡×0.1¡Ñ10-12g)ªºDNA,
¥ç§Y¤@Ó°ò¦]ªº¶q§Y¥i´ú¥X, ¦]¦¹¥»¹êÅç¥i¤ñ¬°¥Ñ¤j®ü¥i¼´°w.
¦¹¹êÅ礤, Y©Ò±ý§äªº°ò¦]»P±´°w¤§¶¡ªº®t²§¸û¤j,
«hÂø¥æ·Å«×¥i°§C¨Ç. ¦bÂø¥æ²G¤¤©Ò¨Ï¥Îªºdextran sulfate¥Øªº¦b«P¨Ï±´°wDNAµ²¦X©óÂø¥æ³B,
¦ý¹ï³æªÑDNAµL¥Î, ¬G¤£¥²¥Î©ó«e³B²z²G¤¤.
¹B¥ÎDu Pont Renaissance Nucleic Acid
Chemiluminescence Reagent ¤ÎRandom Primer Biotin Labeling Kit(with
streptavidin-AP) (²£«~½s¸¹¡GNEL-202, NEL-604)¨Ó¶i¦æ«n¤è¦¡Âø¥æ
²£«~»¡©ú¡G
NEL-202,¤¤§t4²~¸Õ¾¯, ¨C²~§¡¬°170ml, ¨ä¤¤2²~¬°Enhanced
Luminol Reagent, 2²~¬°Oxidizing Reagent.
¦¹²£«~¬O¬°ÁקK¨Ï¥Î©ñ®g©Êª«½è,
¦ý¤S¯à¹F¨ì¬Û¦P¥\¯àªº³]p, ¦]¨ä¯àµo¥X¥ú½u,
¥Î©ó°»´úªþ¦b½¤¤Wªºhorseradish peroxidase, ¦¹²£«~»PRandom Primer
Biotin Labeling Kit¨Ö¥Î, ¦b2¤p®ÉÃn¥ú±¡§Î¤U,
¥i¥H«n¤è¦¡Âø¥æªk´ú¥X¬ù250ngªºDNA§t¶q. (¥ç§Y2.5¡Ñ10-8gDNAªº§t¶q)¦¹²£«~³]pªºì²z¬O,
§Q¥Îhorseradish peroxidase(HRP)·|¶Ê¤Æluminolªº®ñ¤Æ, ¦Ó²£¥Í¥ú.
·í½¤¤W¦³HRP®É, ±N¦¹Oxidizing Reagent¥[¤W¥h, ´N·|¦³¶À¥ú²£¥Í,
¦A¥[¤Wenhanced luminol reagent¥i¨Ï¦¹¥ú¥[±j1,000¿.¦¹¥úªºªiªø¬°428nm,
¦¹¥ú¥i¥ÎDu Pont Reflection Auto radiography©³¤ù°»´ú.
HRP¥iªþ¦bntrocellulose½¤¤W¨Ï¥Î.
¦b¨Ï¥Î®É¥²¶·¨¾¤î¦Ã¬V·»¾¯. ¥]¬Apipettes©Îpipet tips§¡n¨C¦¸§ó´«·s«~.
¦A¸Ë©³¤ù®É¤Á¤ÅÃn¥ú, ¥²¶·¦b·t©Ð¾Þ§@.
¨Ï¥ÎChemiluminescence
Reagent Preparation¤èªk¡G
1.
¦b¨Ï¥Î«e¨úµ¥¶q¤§Bottle
1»PBottle 2²G²V¦X, ¤Á¤Å²V¦X¶W¹Ln¨Ï¥Î¤§¶q, ¥Î¹L§Y±ó.
2.
±N²V¦X¦nªº²GÅé(¨ä¶q¬°¨Ccm2½¤,
¥Î0.125ml), »P½¤©ñ¦b¤@½L¤¤(©Î¥i«Ê½¦³U¤¤),
¨Ï²GÅé»P½¤¥R¤À±µÄ², ¦Ü¤Ö1¤ÀÄÁ, «Ç·Å.
°»´úDNA¡G
1.
©³¤ù¥²¶·«O«ù°®Àê,
¬G½¤¥²¶·¥h°£¤ô¤À, ¥i¥H´½°®©Î»´»´¦bÂo¯È¤W§l°®¤è¦¡°®À꽤.
2.
¦b·t©Ð¤¤,
±N©³¤ù¨ú¥X, ±N§tDNA¤§½¤, ¥H¦³DNAªº±¦V©³¤ù©ñ¦n.
²Ä¤@±i©³¤ù¬°¸Õ¤ù, ¥i¥H¸Õ5¤ÀÄÁ§Y¨R¥X. ¬Ýµ²ªG, ¦A´«·s©³¤ù,
Ãn¥ú2¤p®É.
¨Ï¥ÎRandom
Primer Biotin Labelling Kit¤èªk¡G
¦¹®MKit¦³¤U¦Cª««~¡G
Random Primers and Reaction Buffer 6X ¿@«×, 140£gl
Biotin
nucleotide Mix (¥]¬ABiotim-N6-dATP)
unlabeled
dATP, dGTP, dTTP§¡¬°6X¿@«×, 140£gl
unlabeled
Control DNA, £f Hind III digest, 100ng/£gl, 25£gl
Biotin
labeled control DNA, labeled £f Hind III digest, 50pg/£gl, 50£gl
Water, µLµß®ø¬r¹L, 2ml
Kelnow
Fragment, 1.5~2.5units/£gl, 100£gl
Streptavidim-AP
conjugate, 1,000X¿@«×, 250£gl, Blocking Reagent, ¯»ª¬, 20g
¥t¥~,
n°µ«n¤è¦¡Âø¥æ, ¥²¶·¦³nitrocellulose½¤.
¦b²Ä¤@¦¸¨Ï¥Î«á,
Blocking reagant¥i«O¦s¦b«Ç·Å, ¦Óstreptavidim-AP²G, ¥i«O¦s¦b4¢J.
»¡©ú¡G
¦¹Kit, ¬O¥Hrandom hexamers¨Ó²£¥ÍDNA¼Ð©w,
¼Ð©w®É¥HBiotin-N6-dATP¬°¤§. ¥H¦¹Kit¦X¦¨ªºDNA¤ù¬q,
¤j¬ù¬°300~600bases.
¦b°µÂø¥æ®É,
Biotin-labeled DNA ¥ý denature, ¦b»P¥Ø¼ÐDNAÂø¥æ,¨Ï¥Îªº¬°Âø¥æ½w½Ä²G,
¨ä¤¤§t¦³Blocking Reagent(¥i¬°µL¯×¥¤¯», BSA¤ÎCasein). ¦¹½w½Ä²G¦bKit¤¤¤@¨Ö´£¨Ñ.
¦bÂø¥æ«á¤Î¨R¬~«á,
¦¹½¤¦A¥H¥t¤@¤¤§tBlocking reagintªº½w½Ä²G¨R¬~,
¥H§KµLÃöªº³J¥Õ½è§lªþ¨ä¤W, µM«á, ¨Ï¥Îstreptavidim-AP,
¦¹¬°°ª«×±Ó·Pªº°»´ú±µ¦X¾¯, ¥Î©ó©MBiotin-labeled DNAµ²¦X.
¤@ºØ±`®Äªº¿Ã¥ú°T¸¹,
·|¦b¥[¤JChemilum nesceme reagent«á¨³³tÅã²{, ¦¹°T¸¹¥i«ùÄò24¤p®É.
Biotin-labeled
probe hybridization mix¥i«O¦s¦b-20¢J«½Æ¨Ï¥Î. ¨C¦¸¨Ï¥Î«en¥ýdenature.
¨Ï¥Î¤èªk¡G
¤U¦Cªº¤èªk¥u°÷¼Ð©w25ng¸m1£ggªº¼Ò¤lDNA, ¦¹DNA¥²¶·¯ÂµL³J¥Õ½è,
¦³¾÷·»¾¯µ¥Âø½è. ³Ì§C¿@«×¥i¦Ü1.3ng/£gl¤´¥i¼Ð©w.
¡°¦¹®É»Ý¥t³Æ0.1M
EDTA, pH8.0¥H²×¤î¤ÏÀ³.
1.
¨ú¥XRandom
Primers and Reaction Buffer mix, Biotin nucleotide Mix, Water, Template DNA,
0.1M EDTA²G, ¸m«Ç·Å·»¸Ñ.
2.
±N¤Wz²G¥HÂ÷¤ß¤è¦¡10,000rpm,
5sec, ¨Ï²GÅé»E¦bºÞ©³.
3.
¼Ò¤lDNA¦b¼Ð©w«e¥²¶·¥ýdenature,
±N¦¹DNA§l¤J·L¶qÂ÷¤ßºÞ, ¨Ã¥[¤ô, ¨ÏÅé¿n¬°19£gl, Â÷¤ß»E¶°²GÅé,
±NÂ÷¤ßºÞ¸m95¢J, ¨Ã¥ß§Y©ñ¤J¦B¤¤5min.
4.
¦b¦¹Â÷¤ßºÞ¤¤¥[¤J¤U¦C¡G
Random
Primers and Reaction Buffer Mix
5£gl
Biotin
Nucleotide Mix
5£gl
Klenow
Fragment
1£gl
¨Ï¥þÅé¿n¬°30£gl
5.
Â÷¤ß»E¶°²GÅé,
¦b±N¦¹Â÷¤ßºÞ¸m37¢J, 1hr, ¥i§óªø, ©Îovernight.
6.
¥[¤J5£gl¤§0.1M
EDTA(pH8), ¦¹®É¥i«O¦s¦b-20¢J.
¹w´Áµ²ªG¡G
¦b1hr«á, ¨Ìì¼Ò¤lDNA¿@«×»P¦X¦¨DNA(¥H¼Ð©w)¤§¿@«×¤j¬ù¦p¤Uªí¡G
|
¼Ò¤lDNA¿@«×¡G |
25ng |
100ng |
250ng |
580ng |
1£gg |
|
¦X¦¨¼Ð©wDNA¿@«×¡G |
27ng |
70ng |
270ng |
408ng |
710ng |
YnÀË´ú¼Ð©wªº®ÄªG¦p¦ó, ¥i±N¼Ð©w¤§DNA, »PKit¤¤Biotin¼Ð©wªº¹ï·Ó²ÕDNA¥[¥H¤ñ¸û,
¤èªk¦p¤U¡G
¥ý¨ú¼Ð©w¤§DNA 2£gl,
±N¨ä¨Ì¤Wz¹w´Áµ²ªGªí, pºâ, ¨Ã¥HTE bufferµ}ÄÀ¦Ü6.25pg/£gl, ¤]±NKit¤¤ªºBiotin¼Ð©w¤§DNA¹ï·Ó²Õ¤]µ}ÄÀ¦¨6.25pg/£gl(§Yµ}ÄÀ8¿,
¦]ì¿@«×¬°50pg/£gl). ¦A±N¤Wz¤G²ÕDNA,
§¡¦A¨Ì¤Uªíµ}ÄÀ¡G
|
·L¶qÂ÷¤ßºÞ½s¸¹ |
¤º
®e |
³B
²z ¤è ¦¡ |
|
1 |
6.25pg/£gl |
ì¿@«× |
|
2 |
1.60pg/£gl |
¥Ñ1¤¤¨ú4£gl¥[¤J12£gl T.E. |
|
3 |
0.4pg/£gl |
¥Ñ2¤¤¨ú4£gl¥[¤J12£gl T.E. |
|
4 |
0.10pg/£gl |
¥Ñ3¤¤¨ú¥[¤J12£gl T.E. |
|
5 |
0.025pg/£gl |
¥Ñ4¤¤¨ú¥[¤J12£gl T.E. |
¦A±N¨C²Õ¤¤5¤ä·L¶qÂ÷¤ßºÞªºDNA¤À§O¦U§l¨ú1£gl, ¤À§OÂI¦bnitrocellulose½¤¤W,
¦A¥Huv crosslink±NDNA©T©w¦b½¤¤W, ¦A¥H©³¤ùÃn¥ú10min,
±N¨â²Õµ²ªG¹ï·Ó, ¥iª¾¼Ð©wªº®ÄªG.
¥ç¥i§@¬°¥¼¨Ó°µÂø¥æªº¥Î¶q°Ñ¦Ò. ¨Ì¦¹²£«~¤§³]p, ¥un¦³0.1pgªºDNA¼Ð©w,
´N¯à´ú¥X.
«n¤è¦¡Âø¥æªºÀ³¥Î
¦¹¤@³¡¥÷, ´¿¦b¤â¥U¤¤´£¤Î, ¦¹³B¶È«ÂI»¡©ú¡G
§÷
®Æ¡G
Prehybridization
and hybridization buffer¡G
2X SSC
0.5¢M(w/v)
Blocking Reagent
5¢M(w/v)
Dextran Sulphate
0.1¢M(w/v)
SDS
¼Ð©wªº±´°w(labeled
probe)
Carrier
DNA¥i¥Îsheared, sonicated Salmon Sperm DNA
Stringency
wash buffers
a.
2.0X SSC, 1.0¢MSDS
b.
0.2X SSC, 0.1¢MSDS
Âø¥æµ{§Ç¡G
1.
±Nniteocellulose½¤¤W¥H¦³denatured¥Ø¼ÐDNA¦b2X
SSC¤¤²V¦X, ¨Ï¾ã±i½¤§¡®û³z.
2.
±N¦¹½¤¸Ë¤J½¦³U¤¤,
¥[¤JPrehybridization buffer, ¨Ã¥[¤J³Ì²×¶q50£gg/mlªºCarrier DNA, ¦¹®Ébuffer¶q³Ì¤Ö¬°¨Ccm2½¤¦³0.1ml.
3.
±N½¦³U«Ê¤f,
©ñ¤J65¢J¤ô¯D¤¤®¶Àú, ¦Ü¤Ö1hr.
4.
¦b·L¶q§lºÞ¤¤,
±N±´°wDNA»P300£gl Hybridization buffer²V¦X,¨Ã¥[¤Jcarrier DNA(50£gg/ml),¥[¼ö¦Ü95¢J,
5min, ¨Ã¥ß§Y©ñ¦b¦B¤W5min, ±´°w¶q¬°20£gg/ml,
¥H½¤¤§¤j¤p¦Ó©w. (¨Ccm2, 0.1ml)
5.
¦b¦¹±´°w²V¦X²G¤¤,
¥[¤J0.1ml/cm2ªºhybridization buffer,¸m65¢J.
6.
±N³U¤¤Prehybridization
bufferË¥h, ¨Ã¥[¤J(5)¤§²GÅé.
7.
±N½¦³U«Ê°_,
¦¹®É, µø½¤¤lDNA»P±´°wDNAµ²¦Xªºªø«×, Y¦b500bp¥H¤W®É, «h¸m65¢J,
Y¦b500bp¥H¤U®É, «h¸m60¢J, ©ó®¶Àú¤ô·»½c¤¤, ¹L©].
8.
²Ä¤G¤é,
±N½¤¨ú¥X, ±N¬~½¤¥Îªº2X SSC(§t1.0¢MSDS) buffer¥ý¹w¼ö¦ÜÂø¥æ¿@«×,
¦b¥H¨Ccm2¦Ü¤Ö1mlªº¶q¨Ó¬~½¤15min.
9.
¦b¥H0.2X
SSC(§t0.1¢MSDS), ¬~½¤15min.
°»´úÂø¥æµ²ªG¡G
§÷
®Æ¡G
buffer
1
1X
PBS, pH7.4
¥H0.22£gmÂo½¤¹LÂo
0.05¢MTween
20
0.1¢MSDS
buffer
2
1X PBS
0.05¢MTween
20
0.1¢MSDS
¥H0.22£gmÂo½¤¹LÂo«á¥[¤JBlocking Reagent
0.5¢Mw/v Blocking Reagent
conjugate
solution(°t¦Xbuffer 2)
1X
PBS, pH7.4
0.05¢MTween
20
0.1¢MSDS
0.5¢M(w/v)
Blocking Reagent
1/1,000(w/v)
Streptavidim-AP conjugate
buffer
3
0.1M
Tris-cl., pH9.5
0.1M
NaCl
¤è
ªk¡G
1.
±N½¤©ñ¤JBuffer
1¤¤¬~5min, ¥Î¶q¬°¨Ccm2½¤¦Ü¤Ö10ml.
2.
±N½¤©ñ¤JBuffer
2¤¤1hr, ½w½w®¶Àú, ¥Î¶q¬°¨Ccm2½¤¦Ü¤Ö1ml.
3.
±N½¤©ñ¤Jconjugate
solution¤¤1hr, ½w½w®¶Àú, ¥Î¶q¬°¨Ccm2½¤¦Ü¤Ö0.1ml.
4.
¦b±N½¤©ñ¤JBuffer
1¤¤¬~5min, ¬~4¦¸.
5.
¦b±N½¤©ñ¤JBuffer
3¤¤¬~5min, ¬~2¦¸.
±µ¤U¨Ó¬°¨Ï½¤¤WÂø¥æµ²ªG©ñ¥úªºµ{§Ç, ¨Ï¥Î§÷®Æ¬°NEL 601®M§÷¤¤ªº§÷®Æ.
¨B
ÆJ¡G
1.
±N¥ý«e¬~¦nªº½¤,
Âà¦Ü¤@²M¼ä¥×¤¤.
2.
¥H¨Ccm2,
0.05mlªºCDP-StanTm²G§¹¥þÂл\½¤5min.
3.
±N½¤¥H³z©ú½¦¥¬(¥]³ÑÃĥΪº§Y¥i)¥]¦n,
¥H¨¾¤ô§ËÀ㩳¤ù.
4.
±N§tDNA±ªº½¤»P©³¤ù©ñ¦n,
§¨¤J·P¥ú§¨¤¤, ¥ý´ú¸Õ¤@±i5min, ¨R¥X¬Ýµ²ªG,
¦A¥H¥t¤@©³¤ùÃn¥ú1hr.
¥H¤U¬°½w½Ä²G¤Î¦³Ãö·»²Gªº°t¤è¡G
1.
0.1M EDTA, pH8.0¡G
¡¯¥H10ml¶q·Ç³Æ, ¥i¥Î1.86g Na2-EDTA-2H2O¥[¤J8ml
dH2O¤¤, ¥H5NªºNaOH½Õ¾ãpH¦Ü8.0, ¦b¥HdH2O±N¥þ¶q½Õ¾ã¦Ü10ml.
2.
TE buffer(10mM Tris-Cl, pH7.5, 1mM EDTA)¡G
¡¯¥Hll¶q·Ç³Æ, ¥i±N1.22g¤§Tris-Cl»P0.4g¤§Na2-EDTA-2H2O»P500ml¤§dH2O²V¦X,
¥HHCl½Õ¾ãpH¦Ü7.5, ¦A¥[dH2O¨Ï¥þ¶q¬°ll, ¦A¥H0.22£gmÂo½¤¹LÂo.
3.
20X SSC¡G¥Hll¶q·Ç³Æ¡G
¡¯¥H175.4gªºNaCl¤Î88.2gªºSodium citrate, ¥[dH2O¦Üll,
¦A¥H0.22£gmÂo½¤¹LÂo.
4.
DNA Prehydridization and Hybridization buffer¡G
¡¯2X
SSC
¡¯0.5¢M(w/v)
Blocking Reagent
¡¯5¢M(w/v)
Dextran Sulphate
¡¯0.1¢M(w/v)
SDS
¥H100ml¶q·Ç³Æ¡G
¥H100ml¤§20X SSC, ¥[0.5g Blocking reagent, ¦A¥[50ml dH2O,
¥[¼öÅÍ©Õ¦Ü60¢J, ¥H«KBlocking reagent¯à·»¸Ñ, ¦A¥[¤J5gªºdextran
sulphate(¤À¤l¶q500,000), Åͩզܷ»¸Ñ. ¦A¥[¤J0.1gªºSDS, ¨Ã¥[¤JdH2O¨ÏÅé¿n¬°100ml,
«O¦s¦b-20¢J.
¹w´Áµ²ªG¡G
¦b©³¤ù¤WÀ³¦³¶ÂÂI¥X²{,
YµL,
¥i¯à¬°¼Ò¤lDNA¦³¦Ã¬V,
Y©³¤ù¤Ó¶Â,
¥i¯à¬°I´º¤Ó±j, ³Ì¥i¯à¬°½¤¨ü¦Ã¬V, À³¨¾¤î¥H¤â«üIJºN,
À³À¹¤â®M.
Y¶ÂÂI¤Ó²`,
¥i¤Ö¥[¨Ç±´°wDNA, ¨Ã´î¤ÖÃn¥ú®É¶¡.
µL¶ÂÂI¥ç¦³¥i¯à¬Odenaturation¤£§¹¥þ,
©Î¼Ò¤lDNA¥¼©TµÛ, ©Î±´°w¥¼¯à§¹¥þdenaturation, ¦¹½¤¥i¦A«×¨Ï¥Î.
Y¶ÂÂI¼Ò½k,
¥i¯à¬°©³¤ù²¾°Ê.
¥»®M²Õ³]pì²z¬°, ±NPsorlen-Biotin²G»P®Ö»Ä¦@¸mmicrotiter
plate¤¤, ¥H365nmªºµµ¥~½u·Ó®g15~60min, Psorlens·|»P®Ö»Ä¤¤ªºT, U, Cµ²¦X,
¦h¾lªºPsorlen-Biotin ²G¥i¥ÎbutanolµÑ¥X.
ª`·N:
1.
Psorlen-Biotin²G¨£¥ú¤À¸Ñ, ¬G¥²¶·¥H¾T¹`¯È¥]°_, ¨Ã¸m·t³B,
«O¦s©ó-20©Î-70¢J.
2.
¥»®M²Õ»Ý»PAmbion¡¦s BioDetect Kit°t¦X¨Ï¥Î.
¨B
ÆJ¡G
(¨Ñ¼Ð©w0.5£gg/10£gl®Ö»Ä¤§¥Î,
¤£¦P¶q¥i¨Ì¤ñ²v¤ñ·Ó, ³Ì°ª¶q5£gg/100£gl) (©Ò¦³µ{¦¡À³¦b·t¥ú¤U¶i¦æ)
1.
¨ú¤@microtiter
plate±NDNA¸m¤J®æ¤¤, microtiter plate¸m100¢J¤ô¯D©Îheating plate¤W,
10min, ¨ÏDNA denature, (Y¬°RNA«h¬Ù¦¹¨BÆJ), ¦A¥ß§Y¸mmicrotiter plate©ó¦B¤W.
2.
±N§tPsorlen-Biotin¯»ªº¸ÕºÞÂ÷¤ß7,000xg,
15sec, ¦A¥[¤J33£gl¤§dimethylformamide,
¨Ï·»¸Ñ, ¥H¾T¹`¯È¥]°_, ¨Ã¸m·t³B, «O¦s©ó-20©Î-70¢J.
3.
¨ú1£gl¤§Psorlen-Biotin²G,
¥[¤J§t10£gl®Ö»ÄªºEppendorfÂ÷¤ßºÞ¤¤,
²V¦X«á, §l¤Jmicrotiter plate®æ¤¤.
4.
¥H365nm
UV light¦bmicrotiter plate¤W·Ó45min. (¶ZÂ÷2cm.)
5.
¥[¤J89£gl¤§1X
TE, ²V¦X, §l¤JEppendorfÂ÷¤ßºÞ¤¤.
6.
¥[¤J200£gl dH2O-saturated n-Butanol, vortex, Â÷¤ß7,000rpm,
1min, §l°£¤W²M, ¦p¦¹, «´_2¦¸, ±N¦¨«~«O¦s-70¢J.
¨Ï¥ÎBrightStar Biodetect
(Nonisotopic Detection Kit)ªº¤èªk
¤U¦C¨BÆJ«Y¨Ñ100cm2ªºmembrane¨Ï¥Î, ¤£¦Psize¥i¨Ì·Ó¤ñ²v½Õ¾ã.
¦b¾ãÓ¹Lµ{¤¤membrane ¥²¶·«O«ùÀã¼í.
1.
¥ý¨Ì»Ýn¶q±N5x
wash buffer»P10x assay buffer¥HdH2O½Õ¦¨1x.
2.
¥H1x
wash buffer½w·n¬~membrane 5min, 2¦¸(1ml/cm).
3.
¥HBlocking
buffer½w·n¬~membrane 5min, 2¦¸(0.5ml/cm).
4.
¥HBlocking
buffer½w·n¬~membrane 30min, 1¦¸(1ml/cm).
5.
¥HConjugate
Solution(10ml Blocking buffer¡Ï1£gl Streptavidine alkaline
Phosphatase Conjugate/100cm2)½w·n¬~membrane 30min, 1¦¸.
6.
¥HBlocking
buffer½w·n¬~membrane 10min, 1¦¸(0.5ml/cm).
7.
¥H1x
wash buffer½w·n¬~membrane 5min, 3¦¸(1ml/cm).
8.
¥H1x
Assay buffer½w·n¬~membrane 2min, 2¦¸(0.5ml/cm).
9.
¥HCDP-StarTM½w·n¬~membrane
5min, 1¦¸(5ml/100cm2).
10.¨ú¥Xmembrane
§Ý¥h¦h¾l¤ô¥÷, ¥H«OÂA½¤¥]°_, n¥, ¤£n¦³¹Q§é, ¥B¥u¦³1¼h,
¸m¤J¢æ¥ú¤ù§¨¤¤, «Ç·Å2~4hr (¤£¥²¤Ó¤[). ¦A¥h¨R¤ù.
DNA³sÂê¦X¦¨¤ÏÀ³
PCR¬OÀ³¥Î¤@ºØ¥Ñ°ª·Å¥Í¦s²ÓµßªºDNA¦X¦¨酶, Taq DNA Polymerase, ¥[¤WPrimers¤ÎdNTPs,
¦A¯à±±¨î·Å«×´`Àôªº¦X¦¨»ö¤¤, ¥ý¥[¼ö¨Ï쥻¤§DNA¥ÑÂùªÑ¤À¦¨³æªÑ,
¦A°·Å¦ÜPrimers¥i»P³æªÑDNAµ²¦X, ¦A¤É·Å¦ÜDNA¦X¦¨酶¯à¥R¤À¹B§@,
¤@¬q®É¶¡«á, ¤S¤É·Å¨ÏDNA¤À¬°³æªÑ, ¦A°·Å¨ÏPrimersµ²¦X,¦A¤É¤@ÂI·Å¨ÏDNA¦X¦¨酶¯à¥R¤À¹B§@,
¦p¦¹¤£Â_´`Àô, ¬ù20~30¦¸¤§«á, DNA´N¥i±N¯S©w¤ù¬q¿½Æ»s¹F¼Æ¦Ê¸U¦¸,
¦p¦¹¥Î¥H°»´ú·L¶qDNA©Î´úDNA¤¤¦³µL¯S®í±Æ§Çµ¥, À³¥Î¤Q¤À¼sªx.
§÷ ®Æ¡G
10X¤Î1X PCR reaction buffer
8mM dNTP mix
Oligonucleotide PCR Primers (¤W¦æ»P¤U¦æ¤GªÑ)
DNA¼Ò¤l
5£g/£gl Termus aquaticus DNA Polymerase (Taq Polymerase)
Mineral oil
a thermal cycler
¤è
ªk¡G
1.
¦b·L¶qÂ÷¤ßºÞ¤¤¥[¤J¡G
10£gl 10X
PCR reaction buffer
10£gl 8mM
dNTP mix solution
10£gl 10£gM ¤W¦æ(Upstream) PCR Primer
10£gl 10£gM ¤U¦æ(Downstream) PCR Primer
59£gL
template DNA(1£gg in nuclease free dH2O)
1£gl Taq
Polymerase(2.5£g/£gl)
YÅé¿n¦]¦U¶µ¦¨¤Àªº¿@«×¤§¬G¥¼¹F100£gl ¥i¥H1X PCR buffer½Õ¾ã.
2.
¥[¤J100£gl mineral oil(¨¾¤î»]µo)
3.
³]©wthermal
cycler, ¨Ï¥ý¥[¼ö¦Ü94¢J, ¨ÏDNA¤À¦¨³æªÑ, 2min.
4.
¦b³]©wDNA´_¦X·Å«×,
¦¹·Å«×ÀHPrimer¤§²Õ¦¨¦Ó¤£¦P. ¤jP¥i¥H¤U¦C¸gÅ礽¦¡±À¦ô¡G
Tm¡×81.5¡Ï16.6(logM)¡Ï0.41(GC¢M)¡Ð(500/n)
¨ä¤¤n¡×Primerªºªø«×
M¬O½w½Ä²G¤¤ªºÆQ¤À¿@«×¼¯º¸¼Æ(¤£pMg++ªº¿@«×)
¨Ò¦p,
NaCl¿@«×¬°0.04, Tris¿@«×¬°0.67, «h¬°¡G
0.04(NaCl)¡Ï0.67¡Ñ0.01(Tris)¡×0.047M salt
Y¥H25ÓbpªºPrimer¦Ó¨¥,
¨äTm¬°
Tm¡×81.5¡Ï16.6(log0.047)¡Ï0.41(60)¡Ð(500/25)¡×64
¦Ó³q±`´_¦X·Å«×¬°Tm¡Ï22«×¡×66«×.
¦ýY¤@®É¥¼«K¦ôºâ, «h¥H55¢J¶i¦æ, ¤@¯ë¤]¥i¦¨¥\.
¶i¦æ¤@¤ÀÄÁ.
5.
¦A³]©wDNA¦X¦¨·Å«×75¢J,
2min. ¦b2¤ÀÄÁ®É¶¡, DNA¦Ü¤Ö¥i¦X¦¨1,000bp.
6.
¦p¦¹³]©wthermal
cycler´`Àô3~5¹Lµ{3¦¸.
7.
¨ú¥X10£gl(¨ú¦bmineral
oil¤U¼h²GÅ鳡¤À), ¥H¹qªaÀ˸յ²ªG.
¥H¤U±N¦U¦³Ãö§÷®Æ°Ñ¦Ò¸ê®Æ¦C¥X¨Ñ¤£®É¤§»Ý(¤@¯ë§¡«Y¦V¼t°Óª½±µ±ÄÁʮɯÁ¨ú©Î½Õ¦nªÌ,
¦¹³B¬°Y»Ý¦Û¦æ½Õ°t®É°Ñ¦Ò¥Î)
¡¯8mM dNTP¡G±N2mM¤§¨CºØ(¦@4ºØ)dNTP²V¤J,
«O¦s¦b-20¢J.
¡¯Oligonucleotide
PCR Primers¡G¥HdH2O½Õ¦¨10Um, «O¦s¦b-20¢J.
¡¯10X PCR
buffer¡G50mM KCl
100mM Tris.Cl, pH8.4
15mM MgCl2
200£gg/ml gelatin
¡¯Taq
DNA polymerase¡G³q±`¥H5£g/£gl¿@«×¥X°â, ¦Ó¨Ï¥Î®É¨C100£gl, ¥un1.5~2.5£g§Y¨¬,
¬G¦b¨Ï¥Î«e¥i¥HPCR buffer½Õ¾ã¿@«×. ¦¹酶µLproof
reading¥\¯à, ¥ç¥¼©úÅãµo²{¦³exonucleaseªº¥\¯à.
³Ì¾A©yªº¤ÏÀ³·Å«×¬°75~80¢J.
¡¯¦bPCR¤ÏÀ³¤¤,
¤U¦C±ø¥ó¥²¶·ª`·N¡G
1.
¦Ü¤Ön¦³2£gTaq
polymerase/100£gl reaction
2.
1.5mM¤§Mg+2/0.8mM dNTP mix
3.
100 Pmol each Oligonucleotide PCR Primers
±N¯u®Ö²ÓMªº²ÓM®Ö»P²ÓM¨ä¥L³¡¤À¤À¶},
¥H§Q¨ä¥L¹êÅ礧¥Î.
§÷
®Æ¡G
Lysis
buffer
[°t¤è]
10mM Tris.Cl, pH7.4 3mM
CaCl2
2mM MgCl2
Nonidet
P-40(NP-40) lysis buffer B
[°t¤è]
10mM Tris.Cl, pH7.4 3mM
CaCl2
2mM MgCl2
1¢MNP-40
(«e¤T¶µ°t¦X¥ý°ª·Å°ªÀ£®ø¬r«á, «Ý§N«o¦A¥[¤JNP-40)
§¡½è¾¹
¤è
ªk¡G
1.
¹ï³æ¼h²Õ´°ö¾i²ÓM,
¥i¥ý¨ì¥h°ö¾i²G, ¥H5ml, 4¢J PBS²M¬~²ÓM¤G¦¸,
¦A¥H°ª·Å°ªÀ£®ø¬r¹L¤§³n½¦¨í¤M±N²ÓM¨í¤U, ¨ÃÂ÷¤ß1,500rpm,
5min, 4¢J¡F Y¬°¯BÄa²ÓM, «hª½±µÂ÷¤ß1,500rpm, 5min, 4¢J, ¨Ã¥H4¢J
PBS¬~²ÓM¤G¦¸(Â÷¤ß, Ë¥h¤W²M), ¥»¹êÅ秡¥H5¡Ñ107²ÓM¶q³]p.
2.
±N²ÓM·»©ó15£gl,
4¢J, lysis buffer¤¤, ½w½w²V¦X, 10min.
3.
Â÷¤ß4¢J,
1,500rpm, 5min, Ë¥h¤W²M, ¦A±N²ÓM·»©ó1ml lysis buffer¤¤.
4.
¦A¥[¤J1ml
NP-40 lysis buffer B, ½w½w¥R¤À²V¦X.
5.
±N²ÓM§l¤J§¡½è¾¹,
ÅÍ°Ê10¦¸, ¨ú¤Ö¼Æ²G¸m¦å²Gp¼Æ¾¹,
¦bÅã·LÃè¤UÀ˵ø²ÓM¬O§_¥u³Ñ²ÓM®Ö.
6.
±N¥u³Ñ²ÓM®Öªº²ÓM·»Âà¤JµLµßÂ÷¤ßºÞ¤¤,
Â÷¤ß1,500rpm, 4¢J, 5min.
7.
¥J²Ó§l°£¤W²M,
±N¨I¾ý¤§²ÓM®Ö¸m¦B¤W, ¦A¥[¤J200£gl¤§¥Ìªo«O¦s²G(°t¤è¡G50mM Tris.Cl, pH8.3
40¢M glycerol
5mM MgCl2
0.1mM EDTA),
¨Ï²ÓM®Ö·»©ó²G¤¤,
¦b±N¤§«O¦s¦b-70¢J¤¤.
.¤T¤Q.³J¥Õ½èªº©â´£, ¯Â¤Æ»Pp¶q
´ú³J¥Õ½è¤§¶q¡G
Bradfordªk¡G
§Q¥Î¬V¾¯Coomassie
Brilliant Blue·|»P³J¥Õ½èµ²¦Xªº©Ê½è,
¦A»P¤wª¾³J¥Õ½è¿@«×¤§¼Ð·Ç¦±½u¤ñ¸û, ¦Ó¦ôp³J¥Õ½è¤§¶q.
§÷
®Æ¡G
0.5mg/ml
bovine serum albumin¡]BSA¡^
0.15M
NaCl
Coomassie
Brilliant Blue ²G
¹êÅç¨BÆJ¡G
1.
¦b4¤ä·L¶qºÞ¤¤,
¤À§O©ñ¤J0.5mg/ml BSA²G5, 10, 15, 20£gl¦A¥H0.15M NaCl²G¥[¤J¨Ï¹FÁ`Åé¿n100£gl¦A¥H1¤ä·L¶qºÞ¥[¤J100£gl¤§0.15M NaCl,
¦¹¬°±±¨î²Õ.
2.
¦b¨C¸ÕºÞ¤¤¥[¤J1ml¤§Coomassie
Brilliant Blue²G, ¨Ã¥R¤À²V¦X, ¸m«Ç·Å2¤ÀÄÁ.
3.
¥H¥úÃлö´úA595,
q¥X¼Ð·Ç¦±½u, ¦A´ú¥¼ª¾¿@«×²G, ¤w¬d¥X¨ä¿@«×.
¦ýY¥¼ª¾²G¿@«×¤Ó¤j, ¥iµ}ÄÀ«á¦A´ú.
ªþµù¡G
1.
Coomassie Brilliant Blue²G»sªk¡G¥H¤@Ó1¤½¤ÉªºÀ@§Î²~, ·»¸Ñ100mg¤§Coomassie
Brilliant Blue G-250©ó50ml¤§95¢M°sºë¤¤, ¦A¥[100mlªº85¢Mphosphoric acid²G,
¦A¥[¤JdH2O¨Ï¹F1,000ml, ¦A¥HÂo¯È¹LÂo, ¨Ã«O¦s¦b4¢J¤¤³Æ¥Î.
2.
¥Ìªo,
¬~¼äºë, 2-mercaptoethanol, acetic acid, ammonium sulfate, Trisµ¥§¡·|¼vÅT´ú©wµ²ªG.
.¤T¤Q¤@.¥H¹qªa¤ÀÂ÷³J¥Õ½è
¤@«×¹qªa¥i¨Ì³J¥Õ½èªº¤À¤l¤j¤p¤ÀÂ÷³J¥Õ½è,
¨Ã¯à´ú¥X¦U³J¥Õ½èªººc¦¨¤À¤l¤j¤p¤Î¦h¤Ö³æ¦ì.
¹qªa½¦¤¤ªº³J¥Õ½è¥ç¥i©â¥X.
³J¥Õ½èªº¯Â»P§_¤Î¤À¤l¤j¤p,
¥i¦A¹qªa½¦¤¤¥[¤J0.1¢MSDS¨Ó¤ÀªR. ¦ýY¥[¤JSDS,
«h³J¥Õ½èªº¥\¯à±N³à¥¢.
¦b¹qªa®É,
ª`·N¥Î¹q¤§¦w¥þ. ¦b¶}¹q·½«e±N¥ñ¯S¼ÆÃö¦Ü0,
¶}¹q·½«á¤~½Õ¾ã¤§. Ãö¹q·½«e¥ýÃö¥ñ¯S¼Æ¦Ü0¤~Ãö¹q·½.
°õ¦æ¤@«×¹qªa,
¥B¥Hdenatured¤è¦¡¦æ¤§®É, À³¥ý±N³J¥Õ½è»PSDS¤@°_µNªm, ¦A¥[¤J2-mercaptoethanol(2-ME)©Îdithiothreitol(DTT)¥H¸Ñ¶}³J¥Õ½èªºÂù²¸Áä,
¥H¤À¸Ñ³J¥Õ½èªº¦U³æ¦ì.
¦b¨Ï¥Îªa½¦®É,
acrylamideªº¿@«×¦b5¢M®É, ¥i¥Î©ó60~200KdaªºSDS-denatured³J¥Õ½è, 10¢Mªº¥Î©ó10~70Kda,
15¢Mªº¥Î©ó12~45Kda.
³J¥Õ½è¥i»Pµ¥¶q¤§2X
SDS²G¦b100¢JµN5¤ÀÄÁ, ³Æ¥Î. Yµ²ªGn¥HCoomasassie blue¬V¦â,
©Ò»Ýªº¨C¤Õ¬ù25¦Ü50£gg³J¥Õ½è.
¦p¥H»È¬V¦â, ¥i¥un¤Wz¶qªº1/10. ¨C¤Õ©Ò¥[ªº¶qÀ³¬Û¦P, ¥[¤J1X
SDS¹qªa²G, ¨Ï¹q·¥¯à®û¤J²G¤¤. ¥H0.75mm«áªºªa½¦¦Ó¨¥, mini-gel,
¥Î15mA, ¬ù»Ý2¤p®É. Y¬°1.5mm«áªºªa½¦, «hÀ³¥Î30mA, ¨¾¤î¹L¼ö,
À³¥H¤ô¬y§N«o¤§. ¦bBromphenol blue¬V¾¯¶]¦Ü©³ºÝ®É, §Y¥i°±¤î.
Y«Y«Ddenatured
gel, §Y¤£§t0.1¢MSDS, ³J¥Õ½èªº¤ÀÂ÷¨Ì¨ä¤À¤l¤j¤p,
§Îª¬¤Î¹q·¥¦Ó¤À.
©Ò¥Î¤§²GÅ駡¤£§tSDS¤Î2-ME
or DTT, ¤]¤£¥²µNªm¼Ð¥», ¦ý¦b¼Ð¥»·»¦b2X Sample buffer¤§«á,
nÂ÷¤ß10,000xg 15min, °£¥h¤£·»ªº¨I¾ý.
¦A¨ú¤W²M²G¦Ü¥t¤@·L¶qÂ÷¤ßºÞ¤¤, ³Æ¥Î.
Y±Npolyacrylamide
gel¨Ï¥Î±è«×(gradient)¤è¦¡, ¯à±N³J¥Õ½è¤Àªº§ó²M·¡, ¥B¯à¤À¥X10~200Kdaªº³J¥Õ½è.
¬°¸`¬Ù®É¶¡,
±Ä¥Î¥«°â¤w°µ¦nªºgel, ¥iÁקK¤¾ªøªº³Â·Ð, ¤SÁקK±µÄ²acrylamide¯»(¥¼§Î¦¨polymer«e¹ï¤H¦³®`),
¤ÎTEMEDµ¥ª«½è. ¤S¤£¥²±ÄÁÊgradient makerµ¥»ö¾¹.
©Ò»Ý¤§¦U¶µbuffer°t¤è¡G
1.
5x SDS/electrophorsis buffer¡G
15.1g
Tris base
72.0g
glycine
5.0g
SDS
£»¦A¥[dH2O¦Ü1,000ml,
¤£¥²½Õ¾ãpH.
£»Y±Ä¤£¥Îdenaturation,
«h¤£¥[SDS.
£»¦b¨Ï¥Î®É,
¥[¤JdH2O, ¨Ï¦¨1X, pH§Y¬°8.3.
2.
2X SDS/sample buffer¡G
25ml
4x Tris Cl/SDS, pH6.8 (¨£«á°t¤è)
20ml
glycerol
4g
SDS
2ml
2-ME©Î3.1g DTT
1mg
Bromophenol blue
£»¥[dH2O¨Ï¦¨100ml,
¥H1ml¶q«O¦s¦b·L¶qÂ÷¤ßºÞ²×©ó-70¢J.
£»Y¤£ndenatured³J¥Õ½è,
«h¤£¥[2-ME©ÎDTT, ¤Î§R¥hSDS.
3.
6x SDS/sample buffer°t¤è¡G
7ml
4x Tris Cl/SDS, pH6.8 (¨£«á°t¤è)
36ml
glycerol
1g
SDS
0.93
DTT
1.2mg
Bromphenol Blue
£»¥[dH2O¦Ü10ml.
£»¥H0.5ml¦s·L¶qÂ÷¤ßºÞ¤¤,
¦s-70¢J.
£»Y¤£ndenatured
proteins, «h§R¥hSDS, DTT.
4.
4x Tris Cl/SDS, pH6.8°t¤è¡G
£»±N6.05g Tris base¥[40ml dH2O, ¥H1NHCl½Õ¾ãpH¦Ü6.8,
¦A¥[dH2O¦Ü100ml, ¦A¥H0.45£gmÂo½¤¹LÂo,
¦A¥[¤J0.4g SDS, «O¦s¦b4¢J.
£»Y¤£ndenatured Proteins, «h¤£¥[SDS.
5.
4x Tris Cl/SDS, pH8.8°t¤è¡G
£»±N91g Tris base¥[300ml dH2O, ¥H1NHCl½Õ¾ãpH¦Ü8.8,
¦A¥[dH2O¦Ü500ml, ¦A¥H0.45£gmÂo½¤¹LÂo,
¦A¥[¤J2.0g SDS, «O¦s¦b4¢J.
£»Y¤£¨Ï¥Îdenatured Proteins, «h¤£¥[SDS.
Y±Ndenatured
Proteins»P¥¼denatured Proteinsµ²ªG¤ñ¸û,
¥i±oª¾¤@Ó³J¥Õ½èªººc¦¨³æ¦ì¤§¤À¤l¤j¤p.
¦ýµLªk¥¿½Tpºâ¤À¤l¤§µ´¹ï¤j¤p. ¦]¹qªa«á³J¥Õ½è§Îª¬,
¤j¤p¤Î¹q·¥§¡¦³¼vÅT.
¦pªG¹qªaªºµ²ªG¦³±ø±a¤G´ú¤WÅs²{¶H,
ªí¥Ü¹L¼ö, À³¥H±±¨î·Å«×¬°¤§, Y¬V¾¯ÂX´², «h½w½Ä²GÀ³§ó·s,
Y³J¥Õ½è±ø±aÂX´², «hÀ³¼W±j¹qÀ£
(25¢M), Y²£¥Í««ª½±ø±a, «hªí¥Ü³J¥Õ½è¤¤¦³¨I¾ý,
À³¥HÂ÷¤ß³B²z¼Ð¥», ¦A¹qªa.
Bromphenol
blue solution¡G(working solution)
50¢Mglycerol(v/v)¡Ï10ml/liter concentrated Bromphenol blue
¡@
¤T¤Q¤G.¥Ñ¹qªa½¦¤¤¨ú¥X³J¥Õ½è
¤è
ªk¡G
1.
±Nªa½¦¨ú¥X,
¦Ü©óCoomassie Brilliant Blue¬V¾¯²G¤¤®û15¤ÀÄÁ. «Ç·Å.
2.
±N¬V¦â¤§ªa½¦¦Üdestaining
solution¤¤2hr, 4¢J. (¦¹®É¥i±NKimwipes©ñ¦b®û¬~¥×ªº¥|¨¤,
¥i§l¨ú¬V¾¯)
3.
¥H¤p¤M¤ù±N§t³J¥Õ½èªºband¤Á¤U.
4.
±N¤p¶ôªa½¦¸m4¢J,
¤ô¤¤, 2hr, ¨Ã¨C¹j30min, ´«¤ô¤@¦¸.
5.
±N²M¬~ªºªa½¦¸m10cm°ö¾i¥×¤¤,
¥[10ml¤ô, ±Nªa½¦¤Á¦¨1mm3¥ª¥k¤j¤p, ¨Ã°ï¦b¤@°_,
¨Ã¥H§lºÞ±N¤ô§l°£.
6.
¥HTris/acetate½w½Ä²G,
¤Î¾A·í³z§l½¤, ¹qªR, ±N³J¥Õ½è¥Ñ½¦¤¤¨ú¥X. (©Ò»Ýªº¼Ò¤Õ,
¥²¶·¤ñ©Ò»Ýªº³J¥Õ½è¤À¤l¤p)
7.
¨ÌElectro-Eluter¹qªR³]³Æ¸Ë¸m³]©w,
¨Ã±Nªa½¦¦belution buffer¤¤®û3¤p®É. ¦b³]©w©T©w50v, ¹qªR12hr.
8.
±Nelution
bufferË¥h, ´«¤J³zªRbuffer, ³]©w80v, ³zªR20hr.
9.
¥H°wÀY§l¨ú§t³J¥Õ½èªº²GÅé,
¦s·L¶q§lºÞ¤¤, «O¦s©ó-20¢J, ©Î¥H4¿¶q¤§methanol/acetone 50¡G50v/v±N³J¥Õ½è¨I¾ý¦bÂ÷¤ßË¥h¤W²M«O¦s©ó-20¢J.
ªþµù¡G
¨Ï¥ÎCoomassie
Brilliant Blue¬V¦â³J¥Õ½è®É, ³J¥Õ½èªº¶q¦Ü¤Ön2~3£gg ¤~¯àÅã¥X, ¦Ó¤w»È¬V¦â,
¥un2~5£gg´N¥i¬Ý¥X.
¦UºØ·»²G¤Î½w½Ä²G°t¤è¡G
Destaming
solution¡G
50ml
acetic acid
165ml
methanol
785ml
dH2O
Dialysis
buffer (0.1M NH4HCO3)¡G
±N4.0g
NH4HCO3·»©ó500ml H2O¤¤, ¨Ã¥[¤J0.1¢Mw/vªºSDS.
Elution
buffer (0.05M NH4HCO3)¡G
±N1.98g
NH4HCO3·»©ó500ml dH2O¤¤, ¨Ã¥[¤J0.1¢Mw/vªºSDS.
Soaking
Solution (0.4M NH4HCO3)¡G
±N3.19g
NH4HCO3·»©ó100ml dH2O¤¤, ¨Ã¥[¤J2¢Mw/vªºSDS.
Staining
Solution¡G
1ml
acetic acid
3ml
isopropanol
6ml
dH2O
0.5¢M(w/v)
Coomassie Brilliant Blue solution.
³zªR½¤¤§³B²z¡G
¦³¤À¤l¶q1,000,
2,000, 3,500, 8,000, 10,000, 25,000, 50,000µ¥¤£¦P,
¨Ì³J¥Õ½è¤§¤À¤l¶q¿ï¤Õ¤£¤j©ó©Ò»Ý³J¥Õ½èªº½¤,
±N½¤°Å¤U¤@¬q©Ò»Ýªø«×, ®û¦b 1¢Mammonium bicarbonate, 60¢J, 1hr,
¦A¥HdH2O¬~²b, ¦A®û©ó0.1¢MSDS,
60¢J, 1hr, ¦A¥HdH2O¬~²b.
¥ç¥i¥Î¤£§tSDSªºTris/acetate
buffer¨Ó°µelution©Îdialysis, 4¢J.
¥t¥~¦bgel¤¤³J¥Õ½èªº¬V¦â,
¤]¥i¥Î4M sodium acetate, 1hr, «Ç·Å,
§Y¥iÅã¥X³z©úªº³J¥Õ½è±a¤Î¤£³z©úªºgelI´º.
Y¨Ï¥ÎCoomassie
blue¥²¶·¸gdestain¹Lµ{. ¨Ã¦A¥H7¢M(v/v)ªºacetic acidéw¤§,
¦A¥H¬Û¾÷·Ó¬Û¦sÃÒ.
¹qªa½¦¤¤³J¥Õ½è¬V¦âªk¡G
1.
±Nªa½¦¨ú¥X¸Ë¤J¨Ì¶ì½¦²°¤º,
¨Ã¥[¤J½¦Åé¿n5¿¶qªºfixing solution, »´»´®¶Àú2hr.
2.
±Nfixing
solutionË¥h, ¥[¤JCoomassie staining solution 4hr, ¨Ã»´»´®¶Àú.
3.
Ë¥hCoomassie
staining solution, ¥H50ml fixing solution²M¬~gel.
4.
Ë¥hfixing
solution, ¦A¥[¤J·sªºdestaining solution, »´»´®¶Àú2hr.
5.
Ë¥hdestaining
solution, ¦A¥[¤J·sªºdestaining solution, ª½¦Ü³J¥Õ½è±a²M³BÅã¥X,
¦A±Ngel©ñ¦b7¢Macetic acid¤¤.
6.
·Ó¬Û«O¦s¬ö¿ý.
7.
°®Àêgel(¥Î¤@¯ëªºgel
dryer), ±Ngel¤W¤U¦U³]3MM Whatman filter paper¨Ã¥H³z©ú½¤¥]¦n, ¦A¥H80¢J°®Àê1hr.
¥t¥~¥ç¥i¥Î§Ö³t¬V¦âªk,
¦A30min¤º¬Ý¥Xµ²ªG, ¨ä©Ò¥Î¤§§÷®Æ¦p¤U¡G
isopropanol fixing solution
Rapid Coomassie staining solution
10¢Macetic acid
¤è
ªk¡G
1.
±Nªa½¦¨ú¥X,
¦Ü¶ì½¦²°¤¤, ¥Hisopropanol fixing solutionªw, ¸m«Ç·Å,
µøªa½¦«p«×ªw¤£¦P®É¶¡, 0.7mmªa½¦, 15min¡F1.5mmªa½¦, 30min.
2.
Ë¥hfixing
solution, ¥[¤Jrapid Coomassie blue staining solution, ¸m«Ç·Å20min.
3.
Ë¥hstaining
solution, ¥[¤J10¢Macetic acid, ¥H½w½w®¶Àú1hr, ¦ÜI´º²M·¡.
¥²n®É§ó´«·s10¢Macetic acid²G¦b¬~, §¹¦¨«á, ±N½¦«O¦s¦b7¢Macetic
acid²G¤¤, ©Î¥H¦b³z©ú½¦¥¬¤¤¦s4¢J.
4.
¥²n®É±Nªa½¦·Ó¬Û.
ªa½¦¥ç¥i¥Î»È¬V¦â,
»È·|»P³J¥Õ½èªºsulfhydryl©Mcarboxyl moieties§@¥Î, ¦Ó§e¦â.
¦]±Ó·P«×°ª, ¹Lµ{¤¤À³À¹¤â®M.
§÷
®Æ¡G
Fixing
and destaining solutions
10¢M(v/v)
glutaraldehyde (¨Ï¥Î«e¥H¿@«O¦s²Gµ}ÄÀ©ódH2O¤¤)
Silver
nitrate solution
Developing
solution
Kodak
Rapid Fix sloution A(¡8323917)
¤è
ªk¡G
1.
±Nªa½¦¨ú¥X,
¦Ü¶ì½¦²°¤¤, ¥[¤J½¦Åé¿n5¿ªºfixing solution, ½wºC®¶Àú30min.
2.
Ë¥hfixinig
solution, ¥[¤J5¿½¦Åé¿nªºdestaining solution, ½wºC®¶Àú1hr.
3.
±Ndestaining
solutionË¥h, ¥[¤J½¦Åé¿n5¿ªº10¢Mglutaraldehyde, ¦b©â®ð©Î³q·³B,
½wºC®¶Àú30min.
4.
Ë¥hglutaraldehyde,
¥HdH2O¬~ªa½¦4¦¸, ¨C¦¸30min.
5.
±N¤ôË¥h,
¥H5¿½¦Åé¿nªºAgNO3²G¬V¦â, 15min, ¨Ã®¶Àú¤§.
6.
±Nªa½¦´«¤J¥t¤@²°¤¤¥H5¿½¦Åé¿nªºdH2O¨R¬~,
5¦¸, ¨C¦¸1min, Ë¥h¤ô.
7.
¥H25ml
developing solution¥[¤J500ml dH2O¤¤, ¦A±N¦¹µ}ÄÀ¹L¤§developing
solution, ¨ú5¿½¦Åé¶q, ¥[¤J²°¤¤, ª½¦Ü³J¥Õ½è¬V¦â§e²{.
8.
±Ndeveloping
solutionË¥h, ¥[¤JKodak Rapid Fix Solution A, (¨¬°÷cover gel), 5min.
9.
Ë¥hSolution
A, ±Ngel¥H¤ô¨R¬~5min.
10.±Ngel·Ó¬Û.
¥t¥~ÁÙ¦³¤@ºØnoammoniacal
Silver Staining¨Ï¥Î¤ñ¤W¦C¤èªk§óéwªº·»²G,
¨Ã¥i°»´ú¥X¤Wz¤èªk©Î³\°»´ú¤£¥Xªº³J¥Õ½è.
§÷
®Æ¡G
¦¹ªk©Ò»Ý§÷®Æ»P¤Wªk¦³³\¦h¬Û¦P,
¥t¥~¥[¤U¦C§÷®Æ¡G
5£gg/ml DTT
0.1¢Msilver
nitrate(«O¦s¦b¤£³z¥ú²~¤¤, ¥i«O¦s¬ù¤@Ó¤ë)
Carbonate
developing solution
2.3M
citric acid
¤è
ªk¡G
1.
±Nªa½¦©ñ¤J¤@¬Á¼þ½L¤¤,
©Î¶ì½¦²°¤¤, ¥[¤J100ml fixing solution, ½wºC®¶Àú30min.
2.
Ë¥hfixing
solution, ¥[¤Jdeveloping solution, ½wºC®¶Àú30min.
3.
Ë¥hdeveloping
solution, ¥[¤J10¢Mglutaraldehyde 20ml, ½wºC®¶Àú10min. (À³¦A³q·³B¬°¤§)
(À¹¤â®M) (¦¹¤@¹Lµ{¥i¨Ï·L¶q³J¥Õ½è¤]¯àÅã¥X).
4.
Ë¥hglutaraldehyde²G,
¥H¤ô²M¬~ªa½¦, 1hr.
5.
Ë¥h¤ô,
±Nªa½¦®û©ó100mlªº5£gg/ml²G¤§DTT¤¤, 30min.
6.
Ë¥hDTT,
¤£¥²²M¤ô¨R¬~, ª½±µ¥[¤J100ml¤§silver nitrate, ½wºC®¶Àú30min.
7.
Ë¥hsilver
nitrate¥H²M¤ô¨R¬~ªa½¦¤@¦¸, ¦A¥Hcarbonate developing solution¨R¬~2¦¸.
8.
±Nªa½¦®û©ó100ml
carbonate developing solution, ¨Ã½wºC®¶Àú, ¦Ü¬V¦âÅã¥X¬°¤î.
9.
¥[¤J2.3M
citric acid(¥Î¶q¬°¨C100ml carbonate developing solution¥[5ml), ½wºC®¶Àú10min.
(¦¹¤@¹Lµ{¥Î©ó¥¿ÅpH, Y¥¼¥¿Å, «hµ²ªG¤£¨Î)
10.Ë¥h¤Wz²GÅé,
¥H²M¤ô¨R¬~ªa½¦3¦¸, ²Ä¤T¦¸¨Ã½wºC®ûªw¨Ã®¶Àú10min.
11.±Nªa½¦·Ó¬Û,
©Î±Nªa½¦¥H0.03¢MªºSodium carbonateªw10min,
¦b¨ú¥X¥H½¦³U¸Ë¦n«Ê¤f«O¦s.
¦UºØ·»²G°t¤è¡G
Carbonate
developing solution¡G
0.5ml
37¢Mformaldehyde per liter solution
3¢M(wt/vol)sodium
carbonate
Coomassid
Blue Staining Solution¡G
50¢Mmethanol(v/v)
0.05¢M(v/v)Coomassie
Brilliant Blue R-250
10¢M(v/v)acetic
acid
40¢MdH2O
±NCoomassid
Brilliant Blue R·»©ó°sºë, ¦A¥[¤Jacetic acid¤ÎdH2O¥i«O¦s6Ó¤ë,
¦p¦³¨I¾ý¥i¥H¹LÂo¥h°£¤§.
Destaining
solution¡G
5¢Mmethanol
7¢Macetic
acid
88¢MdH2O
«Ç·Å¤U¥i«O¦s¤@Ó¤ë.
Developing
solution¡G
0.5¢MSodium
Citrate
0.5ml
37¢Mformaldehyde solution
¦A¥[¤JdH2O¨Ï¹F100ml.
¦b«Ç·Å¤U¥i«O¦s¤@Ó¤ë.
Fixing
Solution¡G
50¢M(v/v)methanol
10¢M(v/v)acetic
acid
40¢MdH2O
«Ç·Å¤U¥i«O¦s¤@Ó¤ë.
Isopropanol
fixing solution¡G
25¢M(v/v)isopropanol
10¢M(v/v)acetic
acid
«Ç·Å¤U¥iªø´Á«O¦s.
Silver
nitrate solution (ammoniacal)¡G
±N3.5ml¬ù30¢MªºNH4OH¥[¤J42mlªº0.36¢MNaOH¤¤,
¦A¥[¤JdH2O, ¨ÏÁ`Åé¿n¦¨¬°200ml, ¥HÅÍ©Õ¤lÅÍ©Õ, ¦A¥[¤J8mlªº19.4¢M(1.6g/8ml)
silver nitrate, ¦pªG·»²G²V¿B¥i¦A¥[NH4OH¦Ü¼á²M¬°¤î,
¨ÃÀ³¥ß§Y¨Ï¥Î.
¦¹·»²G¦b¦ÛµM°®Àê¹Lµ{¤¤¦³¥i¯àÃz¬µ,
¬G¥¼¥Î§¹ªº²GÅéÀ³¥Hµ¥¶q1M HCl¨I¾ý, ¦A¥H¤j¶q¤ô¨R¬~¤§.
ªþµù¡G
Coomassie
Brilliant Blue·|»P³J¥Õ½è¬Ûµ²¦X, ¦ý¤£·|»PPolyacrylamide gel¬Ûµ²¦X,
¬G¸g²M¬~«á·|¦³±ø±a¥X²{.
.¤T¤Q¤T.¥H¬Wª¬¼hªRªk¯Â¤Æ³J¥Õ½è
³q±`¥i¥H¤U¦C¨BÆJ«ä¦Ò¡G
¿ï¾Ü¤@ºØ¼hªRªk
¿ï¾Ü¤@ºØbuffer
![]()
¥H¦¹buffer¨Ó®û¦¹¼hªR¥Îªº¶ñ²É¨Ã¶ñ¬W
(¨Ã·Ç³Æfraction collector)
¡õ
´ú¬W¤º¦³®Ä, µL®ÄÅé¿n
¡õ
©ñ¤J¼Ë¥»
¡õ
¦¬¶°¼hªRµ²ªG
¡õ
±N³J¥Õ½è¤¤ÆQ¤À¥h°£
¡õ
¤ÀªR³J¥Õ½èªº¯Â«×¤Î¾¯¶q
°£Immanoaffinity¼hªRªk¥~,
¨ä¥L¼hªRªk§¡µLªk¤@¦¸¹F¨ì³J¥Õ½è¯Â¤Æªº¥Ø¼Ð.
¤@¯ë¦Ó¨¥,
¹ï¥i·»©Ê³J¥Õ½è, ±`¥ý±N²Õ´§¡½è,
¦b¹LÂo¤Î¥HÂ÷¤ß¾÷¥h°£Âø½è, ¦A¥Hammonium sulfate(20¢M~50¢M)±N³J¥Õ½è¨I¾ý,
¦A¥H³zªRªk±Nammonium sulfate¥h°£, ¦b¥Ñ¦¹¶}©l¯Â¤Æ¤§.
¦pªG¦¹¤@³J¥Õ½è¥i@¼ö,
«h¥[¼ö¥H°£¥hproteases¦³§U©ó¨ä¯Â¤Æ.
Y«Yªþ©ómembrane¤Wªº³J¥Õ½è,
«hÀ³¥H«DÂ÷¤l©Êªºdetergent¨Óºé¨ú, ¨Ã¥B¦b¼hªR¤¤¤]n¥[¤J§t¦¹detergentªºbuffer.
.¤T¤Q¥|.Gel-filtration Chromatography
¦¹ªk¥i¨Ì³J¥Õ½èªº¤À¤l¤j¤p°Ï§O¤§,
¨Ã¥i¥h°£³J¥Õ½èªºÆQ¤À, ¤p¤ùÂ_©Î
Ói°ò»Ä.
§÷
®Æ¡G
gel-filtration(GF)
matrix (¿ï¾Üªk°Ñ¦Ò«áªþªí)
GF
buffer
GF
protein
GF
Chromatography column
´ú¤ô¥»ö
(¦³¤ôªw¤¤¶¡ªºÂ²«K¦¡§Y¥i)
Fraction
Collector
1¢Mdextran
blue solution (1G dextran blue in 100ml dH2O)
¤è ªk¡G
1.
¥ý±NGFªºgel
matrix¯»ªw¦bbuffer¤¤¨Ï¥¿Å. Y«Y¶R¤wªwµoªº, n¦b¶ñ¬W«á¥Hbuffer¦h¨R¬~´X¦¸¥H°£¥h§Ü¥Í¯À.
2.
¶ñ¬W,
¥²¶·¤p¤ß§¡¤Ã, ¤£¥i¦æ¦¨¼hª¬.
3.
±µ¤@±ø½¦ºÞ,
¨Ï¥t¤@ºÝ°ª»P¬W¤º²G±»ô.
![]()
¡@
¦b¬W¤l¶ñ¦n¤§«á,
¥i¥H¤Uªk«O¦s¬W¤º²GÅé§K¨ä¬y¥¢
4.
¥H¤@¤§¤â¹qµ©,
¦b¬W«á·Ó, ¦¹«KÀˬd©Ò¶ñªº¬W¦³µLªÅ»Ø.
5.
¥H1¢Mdextran
Blue²G1ml¥[¦b¬W±¤W¤è, ¨Ã¶}©l¥[¤Jbuffer, ÀË´úBed volume.
6.
¦b´ú±oBed
volume«á, ¸Õ±N¤@¤wª¾¤À¤l¶q¤§³J¥Õ½è¼Ë¥»(¿@«×¬ù0.2~0.5mg/ml)¥[¤J1¢Mbed
volume¶q. ¦¹¥~¥i°Ñ¦Ò¬W¤ºÅé¿n¤§pºâ¬°£kr2h, r2¬°¬W¤§¥b®|,
h¬°¬W°ª, YBed volume¬°¥¼ª¾, ¥i¥Hh¡×0.01(§Y1¢M)¦ôºâ¦¹Åé¿n.
7.
¶}©l¥[¤Jbuffer,
¨Ã¶}©l¦¬¶°ÄÀ¥X²G, ¥Hfraction collector¦¬¶°¤§, ¤@¯ë§¡¦¬¶°100¦¸,
¨C¦¸¥HBed volumeªº1¢M¬°·Ç. ¦A´ú¨C¤@Ó¦¬¶°²GªºA280,
±N§t³J¥Õ½èªºÅé¿npºâ¬°void volume, ¤@¯ë¦Ó¨¥, ¤j¬ù§¡¬°Bed
volumeªº1/3.
8.
¦b´ú±ovoice
volume«á, §Y¥i±Nn¤ÀÂ÷ªº³J¥Õ½è·»©óbuffer¤¤, (¥Hbed volumeªº1¢M~5¢M¶q¬°¨Î,
¿@«×¦ôp¤£¶W¹L70mg/ml¬°©y).
9.
´ú¦U¦¸¦¬¶°²GªºA280(¦¹ªi±`°w¹ï§ttyrosine©Îtrytophanªº³J¥Õ½è§¡¥i´ú¥X).
¨Ãpºâ¨ä³J¥Õ½è¤§¶q.
10.¥i±N¦U¦¸µ²ªG¶i¦æ¹qªa.
11.¥ç¥i±N²V¦X³J¥Õ½è¼Ð·Ç²G¤§µ²ªG»P¼Ð¥»µ²ªG¤ñ¸û,
¥H¦ôp¼Ð¥»³J¥Õ½è¤§¤À¤l¶q.
ªþµù¡G
¦¹¤@¤èªk¥ç¥i¥Î©ó³J¥Õ½è¥hÆQ, ±`¥Îªºgel matrix¬°Sephadex
G-25, ¥hÆQ«á¤§³J¥Õ½è·|¦bvoid volume¤¤¥X²{,
¦ÓÆQ¤À¤Î¤pÂø½è·|¦bºò±µBed volume«á¥X²{.
¿ï¾Ü¼hªR¬W¶ñ®Æ(gel matrix)ªº°Ñ¦Ò
¦pªG©Òn¤ÀÂ÷ªº³J¥Õ½è¤À¤l¶q¬O¥¼ª¾ªº,
©y¿ï¾Ü¤ÀÂ÷¤À¤l¶q²[»\½d³ò¸û¼sªº, ¨Ã¥B¦b¸Õ¹L¤§«á,
Y³J¥Õ½è¦b«Ü±µªñbed volume®É´N·|¥X²{,
«hn¿ï¥i¤ÀÂ÷§ó¤p¤À¤lªº¶ñ®Æ¦A¸Õ, Y³J¥Õ½è§¡¥X²{¦bvoid
volume¤¤, «hn¦A¿ï¥i¤ÀÂ÷§ó¤j¤À¤lªº¶ñ®Æ¦A¸Õ.
¤U¦C¬°°Ñ¦Ò¿ï¾Üªí¡G
¥H³J¥Õ½è¤À¤l¤j¤p¤ÀÂ÷³J¥Õ½èªº¬Wª¬¼hªR¶ñ®Æ¿ï¾Ü°Ñ¦Òªí¡G
|
¶ñ
®Æ |
³Ì¤p¤À¤l¤j¤p |
³Ì¤j¤À¤l¤j¤p |
|
Sephadex
G-10 |
¡Ø700 |
|
|
Sephadex
G-25 |
800 |
4,000 |
|
Sephadex
G-50 |
1,500 |
3,000 |
|
Sephadex
G-75 |
3,000 |
70,000 |
|
Sephadex
G-100 |
4,000 |
1¡Ñ105 |
|
Sephadex
G-200 |
5,000 |
2.5¡Ñ105 |
|
Bio-Gel
A-0.5m |
¡Õ10,000 |
5¡Ñ105 |
|
Bio-Gel
A-1.5m |
¡Õ10,000 |
1.5¡Ñ106 |
|
Sephadex
4B |
60,000 |
20¡Ñ106 |
|
Sephadex
2B |
70,000 |
40¡Ñ106 |
³q±`¥¿¦¡¥Î©ó¤ÀÂ÷³J¥Õ½èªº¬W¤l,
¦Ü¤Önªø50cm, ª½®|1~2.5cm, ¥Î¥H¥hÆQªº«h25cm, ª½®|2.5cm¬°¨Î.
°t
¤è¡G
Desalting
solution¡G
0.05M
NH4OH©Îacetic acid§¡¥i, ¦]¦¹¤GºØ§¡¦³´§µo©Ê,
¦b°®Àê®É¥i§¹¥þ°£¥h.
Gel-filtration
buffer¡G
Tris,
phophate¤Îacetic buffer¥H¤£¦PpH¨Ó¨Ï¥Î, ¨ÏÂ÷¤l¿@«×¦Ü¤ÖÀ³¦b0.05M,
¥H§K»Pgel matrix©Òn¤ÀÂ÷ªº³J¥Õ½è°_§@¥Î. ¦p¦³¥²n¥i¥[NaCl,
ureaµ¥, ¨Ï³J¥Õ½è¥R¤À·»¸Ñ.
Gel-filtration
protein standards¡G
¥i¦V¼t°Ó±ÄÁʲV¦X¼Ð·Ç²G©Î¦Û¤v±N¤wª¾¤À¤l¶qªº³J¥Õ½è²V¦X¨Ï¥Î.
¨Ò¦p¡GBSA
¤À¤l¶q66,000
ªþµù¡G
1.
Gel filtration¬O¨Ì¤À¤l¶q¤j¤p¤ÀÂ÷³J¥Õ½è, ·U¤pªº¤À¤l,
·U·|Æp¤Jmatrix(¶ñ®Æ)ªº¤Õ¤¤, ©µ¿ð¬y¤U¨Óªº³t«×,
¥ç¥i±Ä°ª®Ä²G¬Û¼hªR»ö(HPLC, high-performance liquid chromatography)³B²z,
¦ý¨Ï¥ÎHPLC®É, void volume¬OBed volumeªº1/2¦Ó«D1/3.
2.
Y¤£·»©ó¤ôªº³J¥Õ½è,
¥i¸Õ·»©ó6M guanidine.Cl¤Î8M urea²G¤¤.
3.
¦b¬W¤l¶ñ¦n,
¤£¨Ï¥Î´Á¶¡, ¨¾¤î²Óµß´F¥Í, ¥i¦bbuffer¤¤¥[¤J0.02¢MªºSodium
azide, ¦ý¦b¨Ï¥Î«eÀ³¥Îbuffer±N¦¹§tsodium azideªº²GÅé¨R°£.
4.
¨Ï¥Î¤§¼Ë¥»¶q¤£©y¦h¹Lvolumeªº5¢M.
5.
¬y³t¤£©y¤p¹L2cm/hr©Î¤j¹L10cm/hr.
6.
¶ñ¥Rª«¦b90¢J,
¬ù5¤p®É¥i¿±µÈ¦Ü¥i¥Îµ{«×.
7.
¬Wª¬¼hªR°£¥H¤À¤l¤j¤p¼hªR¥~,
¤W¦³¥HÂ÷¤l¥æ´«¼hªR, §K¬Ì¿Ë©M¼hªRµ¥¤è¦¡, ¦³¾÷·|¦A¦æ¤¶²Ð.
.¤T¤Q¤.¥HHPLC¯Â¤Æ³J¥Õ½è
¦¹ªk¥ç¦³¥H¤À¤l¤j¤p,
Â÷¤l¥æ´«, °f¬Û, ¹½¤ô©Ê¥æ¤¬§@¥Îµ¥¤£¦P¤è¦¡.
HPLC¾A©ó·L¶q³J¥Õ½èªº¤ÀÂ÷,
¥B¥i¦bµu®É¶¡¤º¹F¦¨. °f¬Ûªk³õ·|¨Ï³J¥Õ½è¤À¤l¥¢¥h¥Íª«¬¡©Ê,
Â÷¤l¥æ´«»P¹½¤ô©Êªk§¡µL¦¹¯ÊÂI,
¤À¤l¤j¤pªk©Ò¤Àªº¤À¤l¤j¤p½d³ò·|¤ñ´¶³q¥Îªº¬Wª¬¼hªR¤p¤@¥b,
¥B¥i¹ï«Ü¤p¶qªº¼Ë¥»¶i¦æ¤ÀÂ÷.
¦¹³B¶È¤¶²Ð¥H¤À¤l¤j¤p¨Ó¤ÀÂ÷³J¥Õ½èªº¤èªk.
¦¹ªk¨Ì³J¥Õ½è¤À¤l¤j¤p, ¤j¤À¤l¥ý¤À¥X, ¤p¤À¤l«á¤À¥X.
§÷
®Æ¡G
degassed,
HPLC-grade H2O
size-exclusion(SE)
buffer
SE
protein standards
0.75¡Ñ30cm
SE column
¤è
ªk¡G
1.
±N«O¦s²G(storage
solvent) (¦¹³B¨Ï¥Îmethanol)¥Ñcolumn¤¤¬~°£(¥Îdegassed HPLC-grade H2O),
¥Hflow rate 1ml/min.
(¦b¨Ï¥Î§¹¤§«á, ¥H¤ô¬~¥hbuffer salts, flow rate
1ml/min 30min, ¦A¥Hmethanol¬~column 30min, 1ml/min)
2.
¦b«Ç·Å¤U¨ÏSE
column¥¿Å©ó1ml/min, H2O¤¤.
3.
¸Õ´ú¤@¦¸,
¥H100£gl SE buffer¨Ó´ú,
±Nµ²ªG¦C¦L¯È¤Wµe¤W¤@¾îªí¥Ü¶}©l³B, ¨Ã³]©w¯Èªº³t«×¬°0.5cm/min,
¦Ó§l¦¬«×ªº³æ¦ì«hÀ³¨Ì³J¥Õ½è¿@«×½Õ¾ã, 0.1©y©ó100pmol, 0.3©y©ó500pmol,
0.5©y©ó1nmol,1.0©y©ó2nmol, Yµ²ªGÅã¥Ü¦³¦Ã¬V¤§®pªi,
¥B¸g¤@¦b´úÅ秡µLªk®ø°£, «hbuffer©Îcolumn©Î¤GªÌ§¡n§ó´«¤F.
4.
±NSE³J¥Õ¼Ð·Ç²GÂ÷¤ß5min,
2,000xg, ©â¨ú100£gl´ú¸Õ,
¦pªG®p°ª¶W¹L¦C¦L¯È¤j¤p, ¥i½Õ¾ã¤§, Yµ²ªG¤ñvoid volumn¤j©ó2.5¿¥H¤W,
«hªí¥Ü³J¥Õ½è§lªþ¦bcolumn¤W.
5.
¨M©w¨CÓ®pªºelution
volume, ¦bø¥Hlog10¬°Áa¶b, ¦U®p¤§elution volumn(ml)¬°¾î¶bªº¹Ï,
¥H«K°µ´ú¥¼ª¾¼Ð¥»ªº°Ñ¦Ò.
6.
±µ¤U¨Ó®y¼Ð¥».
¤èªk¤ñ·Ó¹Lµ{3, 4.
SE
buffer°t¤è¡G
20mM
Sodium acetate, pH5.6
150mM
NaCl
SE
protein standards¡G
2.0mg
thyroglobulin
4.0mg
catalase
3.0mg
bovine serum albumin
3.0mg
ovalbumin
4.0mg
ribonuclease A
¦A¥[6ml
SE buffer¨Ã½w½w²V¦X, ¥²¶·§¹¥þ·»¸Ñ,
¨ÃÀ³¦bÅã·LÃè¤U¬d¬ÝµL¨I¾ý«á, ¦bÂ÷¤ß¤@¦¸, ¨ú¤W²M²G¨Ï¥Î.
ªþµù¡G
1.
SE HPLC ¼hªRªk, ©Ò±oªº¨CÓ³J¥Õ½èªºelution volume»P¦U³J¥Õ½èªºlog10(¤À¤l¶q)¦³Ãö.
2.
SE buffer¥ç¥i¥ÎSodium phosphate(pH5~8)¨Ã§t0.1~0.4M¤§NaCl.
3.
©Ò±o¤§µ²ªG¥i¦A¥H¹qªaªk¨Ó´ú¤À¤l¶q.
4.
SE-HPLC¼hªR¬W¤§¿ï¾Ü, ¥i°Ñ¦Ò¦p¤U¡G
Toya
Soda SW
G
2,000 SW ¥Î©ó¤À¤l¶q30,000¥H¤U
G
3,000 SW ¥Î©ó¤À¤l¶q30,000¦Ü500,000
G
4,000 SW ¥Î©ó¤À¤l¶q500,000
.¤T¤Q¤».¥ÑBlot Transfer MembranesÀË´ú³J¥Õ½è
¦b¹qªa½¦¤¤ªº³J¥Õ½è, ¥i¥HÂಾ¦Ünitrocellalose½¤¤W, ¤Z¶q¡Ù50ngªº³J¥Õ½è±ø±a,
¥i¥H¥ÎIndia ink¬V¦â¦Ó§e¶Â¦â.
§÷
®Æ¡G
Tween
20²G¡G
0.3¢M(v/v)
Tween 20·»©óPBS, pH7.4 India Ink²G
0.1¢MIndia
ink in Tween 20²G
¤è
ªk¡G
1.
±N¤wBlot¦bnitrocellulose½¤¤W¤§³J¥Õ½è,
¤@¦P©ñ¤J¶ì½¦²°¤¤, ¥HTween 20²G®ûªw, ¨Ã½wºC®¶Àú, ¦@¬~2¦¸,
¨C¦¸20¤ÀÄÁ.
2.
±N½¤¥HIndia
ink¬V¦â3hr, ©Î¹L©]¥ç¥i.
3.
±N½¤¥HTween
20²G¨R¬~, ¨Ãdestain(¥ç¥ÎTween 20²G), ¦Ü²M·¡¬°¤î.
¦A±N½¤¨ú¥X´½°®.
¤Wz¹Lµ{©|¥i³Ì¹w¥ý³B²z,
¥H¥[±j¬V¦â®ÄªG.
§÷
®Æ¡G
1¢MKOH
PBS
¤è
ªk¡G
1.
±N§t¦³³J¥Õ½èªº½¤©ñ¤J§t1¢MKOHªº¬Á¼þ½L¤¤,
®û5¤ÀÄÁ.
2.
¥HPBS®û¬~2¦¸.
ªþµù¡G
¦b³B²z½¤®É§¡À³¥H§¨¤l³B²z, ¤Å¥H¤âª½±µ±µÄ².
.¤T¤Q¤C.Western Blotting
³J¥Õ½èSDS-PAGE(Polyacrylamide
gel electrophoreais) ©ÎThin layer chromatography, ¦AÂà¦Ünitrocellulose paper¤W,
¦A¥Hantibody±´°wªþ¨ä¤W, ¦¹antibody¥i¥Hhorseradish peroxidase(HRPO)-IgªþµÛ,
¦A±N¦¹½¤®û¤J§@¥Î¦¨¤À¤¤¨ÏÅã²{µ²ªG.
§÷
®Æ¡G
0.1¢MSDS
in PBS
Electroblotting
buffer
Ponceau
S Solution
Blocking
buffer
Primary
antibody
Horseradish
peroxidase(HRPO)-anti-Ig conjugate
PBS
Diaminobenzidine(DAB)
substrate solution
Whatman
3MM filter paper
Scotch-Brite
pads(3M)
0.45£gm nitrocellulose
mambrane filter
Electroblotting
apparatus or Transflot appratus
Heat-sealable
plastic bag Photographic equipment
Photographic
equipment
Plastic
box
¤è
ªk¡G
1.
º¥ý±N³J¥Õ½è¼Ð¥»¹qªa.
2.
¥HSDS-PAGE¹qªa¼Ð¥»(²Óµßµß¸s©Î·»¸Ñ«á¤§µß¸s¥i¥Hª½±µ¥[¤J0.1¢MSDS²G¤¤load¦Ügel¤W,ª`·Nn¦³¤@¤Õ©ñ³J¥Õ½è¤À¤l¶q¼Ð·Ç²G).(¥»¹êÅç«Ç¨Ï¥ÎªÌ¬°8¡Ñ10¡Ñ0.5cmªºmini
gel,¥B¬°±è«×gel,¥Ñ4¢M~20¢M¤§acrylamide±è«×).
3.
¸Ë³]Western
blot³]³Æ, ª`·NÀ¹¤â®M, ¥H§K¤â¤W¤â¯×¨Ï³J¥Õ½èµLªkBlot¦Ü½¤¤W.
¨ä¸Ë¸m¦p¤U¹Ï¥Ü¡G
![]()
![]()
![]() ¨Ï¥Î14V,
4¢J, 1~16hr¥i§¹¦¨. ¨Ï¥ÎElectroblotting buffer.
¨Ï¥Î14V,
4¢J, 1~16hr¥i§¹¦¨. ¨Ï¥ÎElectroblotting buffer.
3.
±Nnitrocellulose
paper©ñ¤JPonceau S solution 5min, ¨Ó±N³J¥Õ½è¬V¦â, ¦b®û¤J¤ô¤¤destain
2min, ±N¦¹µ²ªG·Ó¬Û.
4.
±N½¤©ñ¦b¶ì½¦³U¤º,
¥[¤Jblocking soluting(¨C10¡Ñ15cm2¤j¤pªº½¤¥Î5ml), ±N³U«Ê¤f,
½wºC®¶°Ê30min, ¦A¥´¶}³U¤f¤@¨¤, Ë¥h²GÅé.
5.
±NPrimary
antibodyµ}ÄÀ(³q±`monoclonal antibodiesµ}ÄÀ1¡G1,000, ¨ä¥L«hµ}ÄÀ1¡G100),
¦A¥H¨C10¡Ñ15cm2½¤¥Î5ml¨Ó®û, ¨Ã½wºC®¶°Ê30min.
6.
±N½¤¥Ñ³U¤¤¨ú¥X(À¹¤â®M),
©ñ¤J¶ì½¦¬Ö¤¤, ¥H200ml PBS¬~3¦¸, ¨C¦¸5min.
7.
µ}ÄÀHRPO
conjugate(¥Îblocking buffer).
8.
±N½¤¸Ë¤J½¦³U,
¥H5ml HRPO conjugateµ}ÄÀ²G®û30min.
9.
Ë¥hHRPO
conjugate²G, ¨ú¥X½¤, ¥H200ml PBS¬~3¦¸, ¨C¦¸5min.
10.±N½¤¥H·í³õ°tªºDAB
substrate²G®û3min, (ª`·NDAB²G¦³PÀù©Ê, ¤p¤ß¨Ï¥Î).
11.·Ó¬Û¦sÃÒ.
¦UºØ·»²G°t¤è¡G
Blocking
buffer
1g
§Y·»²æ¯×¥¤¯»ªw¤J100ml PBS¤¤
Diaminobenzidine
(DAB) substrate solution¡G
50ml
3,3-diaminobenzidine
2ml
1¢MCoCl2 in H2O
98ml
PBS
0.1ml
30¢MH2O2 (¦b¨Ï¥Î«e¤~¥[¤J)
(ª`·NDAB¦³PÀù©Ê,
n¤p¤ß¨Ï¥Î)
Electroblottiny
buffer (20mM Tris/150mM glycine, pH8)¥[14.5gªºTris base¤Î67g glycine¦Ü4¤½¤ÉªºdH2O¤¤,
±NpH½Õ¦Ü8.0, ¦A¥[1,200mlªºmethanol, ¦A¥HdH2O¨ÏÅé¿n¥[¦Ü6¤½¤É.
Poncean
S solution (0.5¢MPonceaus S, 1¢Macetic acid)¡G
0.5g
Ponceau S
1ml
glacial acetic acid
¥HdH2O¥[¦Ü100ml
Horseradish
peroxidase-anti-Ig Conjugate¡G
§¡¦V¼t°Ó±ÄÁÊ,
¨Ã¤À¸Ë0.025ml¾¯¶q«Ý¥Î.
ªþµù¡G
Western
Blotting§Þ³N¬Û·í±Ó·P, ¥i°»´ú¦Ü1ngªºantigen.
²¤¶¡G
¤HÅ餺ªº²ÓM¹J§Üì®É,
·|¨ü¨ë¿EÁc´Þ, ¦Ó²£¥Í¤j¶q¦³±M¤@©Êªº§ÜÅé(monoclonal antibody).
¦Ó§Ü¤¸±`¤Þ°_¤£¦PªºB²ÓM²£¥Í§ÜÅé,
¬G¦b¦å²G¤¤ªº§ÜÅé¹ê»Ú¤W¬O¦h¤¸©Ê§ÜÅé(polyclonal antibodies),
¨äì¦]¬O¦¹§Ü¤¸±`§t¦³¤£¥u¤@³BP§ÜÅ骺³¡¦ì(epitopes),
¨CÓ³¡¦ì³£¥i¤Þ°_¤@Ó¤£¦PB²ÓM§ÜÅé.
§ÜÅ馳¤ºØ,
IgG, IgA, IgD, IgE¤ÎIgM, ¹ï¦P¤@Ó¤H¦Ó¨¥, ¦¹5ºØ§ÜÅ駡¹ï¦P¤@§Ü¤¸¦³§@¥Î.
§ÜÅ骺§Îª¬¦pY¦r§Î, ¦³¤G±ø»´Áå, ¤G±ø«Áå. »´Áå¤S¦³K©M£f¤GºØ,
(¦ý¦P¤@§ÜÅé¥u§t¨ä¤@), ¦ý«Áå«h¥u¦³¤@ºØ. §YIgG¬O£^, IgA¬O£\,
IgD¬O£_, IgM¬O£g, IgE¬O£`.
¤£½×»´,
«Á姡§t¦³Åܲ§ºÝ(variable region)»P«í±`ºÝ(constant region),
»P§Ü¤¸§@¥Îªº³¡¤À¬O¦b»´, «ÁåÅܲ§ºÝªº°ª«×Åܲ§(hypervariable
region)³¡¤À, ¤j¬ù¯¸15Å¡Ñ20Å¡Ñ15ŪºªÅ¶¡¤j¤p.
§ÜÅ餧©Ò¥H¯à¦³¦p¦¹¦hÅܤÆ,
¨Ã«D¤Hªº°ò¦]¦³¦p¦¹¤j¶q, ¦Ó¬O¦bB²ÓM¦¨¼ô¹Lµ{¤¤,
¨ä°ò¦]«²Õ(¦³«Ü¦h«í±`ºÝ, Åܲ§ºÝ, ³s±µºÝ, ÅܤÆdiversityºÝªº°ò¦],
¥i¥H«²Õ±Æ¦C), ¥i¥Hºc¦¨¤£¦Pªº§ÜÅé.
±N酶»Î±µ¦Ü§ÜÅ餧§Þ³N
±N酶»Î±µ¦Ü§ÜÅé¤W,
¬O¨Ï酶(¨Ò¦phorweradish peroxidase HRPO, ©Îalkaline phosphatase)»P§ÜÅé§Î¦¨Ã©wªº.
¥B¤£¼vÅT酶»P§ÜÅ餧¥\¯à.
¥HHRPO»Î±µ¬°¨Ò,
¨ä¤Æ¾ÇÅܤƦp¤U¡G
![]()
![]()
¦¹¤@§Þ³N,
¥i¥Î©óEnzyme-linked immounoworbent assay (ELISA)¤Îwestern boltting,
¨ä¤èªk¦p¤U¡G
§÷
®Æ¡G
1mg/ml
antibody solution
0.1M
phosphate buffer, pH6.8
Horseradish
peroxidase (HRPO)
0.1M
Carbonate buffer, pH9.2
Sodium
periodate (NaIO4) solution, freshly prepared
Sodium
borohydride (NaBH4) solution, freshly prepared
Saturated
ammonium sulfate (NH4)2SO4 solution
Tris/EDTA/NaCl
(TEN) buffer, pH7.2
BSA
Glycerol
Dialysis
membrane
Pasteur
pipet fitted with glass wool
Sephadex
G-25, medium
¤è
ªk¡G
1.
±N1mg/ml§ÜÅé¥H2¤½¤É0.1M
phosphate buffer pH6.8³zªR, ¹L©],
4¢J ½w½wÅÍ©Õ. (§ÜÅé¶q¥i¥HA280/1.44¡×mg Ig/ml¨Ópºâ)
(³zªR½¤¼v 50¢Methanol®û¤@¤p®É,
¦A¥H10mM NaHCO3®û¤@¤p®É, ¦A¥H1mM EDTA®û¤@¤p®É, ¦A¥HdH2O¨R¬~,
¦A«O¦s¦bphosphaed buffer¤¤, 4¢J, ¬°¨¾²Óµß¥Íªø, buffer¤¤¥i¥[¤J0.01¢Mªºsodium
azide).
2.
·»10mgªºGRPO©ó1mlªº0.1M
carbonate buffer, pH9.2¤¤.
3.
±N0.25ml·s°t¦nªºNaIO4²G»P0.25mlªº10mg/ml
HRPO/carbonate²G²V¦X, »\ºò»\¤l, ¸m«Ç·Å2hr(ÁקK¥ú·Ó).
4.
¦b¤@¤äPasteur
pipette¤¤©ñ¤J¾A¶qglass wool, ±N¥X¤f³B¥Hparafilm¥]¦n, ¦A±N1ml¥H³zªR¹Lªºantibody²G,
¥[¤J0.5mlªº10mg/ml HRPO²G¤¤, ¦A±N0.25gªºSephadex G-25¥[¤J¦¹antebody/HRPO²V¦X²G¤¤
(¦¹¤@¨BÆJ¥i¼W¶i酶»P§ÜÅ餧µ²¦X). ±N¦¹²V¦Xª«¥[¤J¦¹Pasteur
pipette¤¤.
5.
¸m©ó·t«Ç,
«Ç·Å3hr.
6.
±N¦¹Column¥H0.75mlªºCarbonate
buffer±Nconjugate¬~¥X, «O¦s.
7.
¦b¦¹ÄÀ¥X²G¤¤,
¥[¤J38£glªº·s°t¦n¤§NaBH4²G, ¦b«Ç·Å, ·t«Ç,
¸m30min.
8.
¦A¥[¤J112£glªºNaBH4²G, ·t«Ç, ¸m60min.
9.
¦A¥[¤J¹¡©M0.9ml
(NH4)2SO4²G, ½w½wÅÍ©Õ30min, 4¢J, Â÷¤ß15min,
10,000xg.
10.Ë¥h¤W²M,
±N¨I¾ýª«·»©ó0.75mlªºTEN¤¤.
11.³zªR¦¹²G,
4¢J, 2¤½¤ÉªºTEN, ¹L©], ²Ä¤G¤Ñ´«¹L¤@¦¸TEN²G, ¦A³zªR4hr.
12.±N³zªR½¤¤ºª«¨ú¥X,
¥[¤J¾A¶qBSA, ¨Ï¦¹²G¤¤³Ì²×BSA¶q¬°20mg BSA/ml.
13.¥[¤Jµ¥¶q¤§glycerol¨Ã«O¦s¦b-20¢J.
°t¤è¡G
0.1M
Carbonate buffer, pH9.2¡G
1.36g
Sodium carbonate
7.35g
Sodium bicarbonate
950ml
H2O
¥H1M
HCl©Î1MªºNaOH½Õ¾ãpH¦Ü9.2¦A¥[dH2O¨ÏÅé¿n¦¨¬°1¤½¤É.
0.1M
phosphate buffer, pH6.8¡G
«O¦sA·»²G¡G0.2M¡G31.2g
NaH2PO4©ó1¤½¤ÉªºdH2O¤¤
«O¦sB·»²G¡G0.2M¡G28.39g
NaH2PO4©ó1¤½¤ÉªºdH2O¤¤
²V¦X51mlªºA²G»P49mlªºB²G,
¤Î100mlªºdH2O¦¨¬°¨Ï¥Î·»²G.
¹¡©Mammonium
sulfate (NH4)2SO4²G¡G
±N1.21g
Tris base¥[¤J990ml dH2O¤¤, ¨Ï¦¨0.01M Tris²G, ½Õ¾ãpH¦Ü7.0,
¦A¥[dH2O, ¨ÏÁ`Åé¿n¬°1¤½¤É, ¶q767gªº(NH4)2SO4¥[¤J¦¹Tris²G¤¤,ÅÍ©Õ,
¨Ã¥[¬°¼ö, ¨Ï·», ½Õ¾ãpH¦Ü7.0, ¨Ã«O¦s¦b4¢J, (NH4)2SO4ªºµ²´¹·|¨I¾ý¥X¨Ó.
Sodium
borohydride (NaBH4)²G¡G
5mg
NaBH4/ml dH2O, ¥²¶·¥Î«e¤~°t
Sodium
periodate (NaIO4)²G¡G
1.71mg
NaIO4/ml dH2O (¥Î«e¤~°t)
Tris/EDTA/NaCl(TEN)²G,
pH7.2¡G
¦b930ml dH2O¤¤¥[¤J¡G
0.06g
Tris base
0.37g
Na2 EDTA
8.77g
NaCl
½Õ¾ãpH¦Ü7.2(¥HHClºw©w)
¥[dH2O¨ÏÅé¿n¦¨¬°1¤½¤É
ªþµù¡G
1.
¨Ï¥Î¦¹ªk,
¬ù1ng/ml¦Ü10ng/mlªº§Ü¤¸¥i¥H°»´ú¨ì.
2.
¦b¨Ï¥Î®É,
¥i±Nµ²ªGµ}ÄÀ100¦Ü10,000¿. ¬O®ÄªG¦p¦ó¦Ó©w.
·Ç³Æ²Óµß§Ü¤¸
§÷
®Æ¡G
E.Coli(ªø©ó°ö¾i²G¤¤)
Cell
resuspending buffer
Lysozyme
solution
Tris/EDTA/NaCl(TEN)
buffer
10¢MSDS
8M
urea
¤è
ªk¡G
1.
±N5mlªºE.Coli²G¦b®à±Â÷¤ß¾÷Â÷¤ß2,500rpm,
10min, Ë¥h¤W²M, ±N¨I¾ý²Óµß·»©ó5ml resuspending buffer¤¤,
¥R¤À²V¦X(Votex).
2.
§l¥X1ml²Óµß²G¤J1.5mlªº·L¶qÂ÷¤ßºÞ¤¤,
¸m¦B¤W¦A¥[¤J0.2mlªºlysozyme²G, «Ý5min.
3.
Â÷¤ß3,000rpm,
5min, «O¯d¤W¼h, ±N¨I¾ýª«¥H1.2ml TEN·»¸Ñ¤§. (¦]¬°¦³¨Ç³J¥Õ½è¬O¤£·»©ó¤ô,
¬G¤GªÌ§¡À³«O¯d)
4.
¦b¨C¤@ºØ¼Ë¥»¤¤¦U¥[¤J65£glªº10¢MSDS,
¸m37¢J, 10min, ¦¹®É¼Ë¥»§Y¥i¨Ï¥Î, Y¤£¨Ï¥ÎÀ³§Ná«O¦s,
Y¦³¥²n¥i¥H8M urea²G(4.8g urea¥[¤J10ml²G¤¤), ³B²z³J¥Õ½è.
°t¤è¡G
cell
resuspending buffer (10mM HEPES)
2.38g
HEPES
¥[dH2O©Î1
liter
ªþµù¡G
1.
¦b§K¬Ì¾Ç¹êÅ礤,
Enzyme-Linked Immunolorbent Assays(ELISA)¬O±`¥Î©ó°»´ú²Óµß©Î§Ü¤¸ªº¤èªk.
¤@¯ë¤À¬°ª½±µªk, §Y±N§Ü¤¸©ñ¤Jmicro titer plate, ¨ÏªþµÛ¦b¤º¾À,
¦A¥Hdiluting buffer¨Ï¥¼³QªþµÛ³B¯à¤£±µ¨ü§ÜÅéªþµÛ,
±µªÌ¥[¤J¤w»Î±µ酶ªº§ÜÅé, ¦A¬~¥h¦h¾lªº§ÜÅé,
¦A¥[¤J酶ªº§@¥Îª«, ¨Ï²£¥Í¤ÏÀ³.
¥t¤@ºØ¬°¶¡±µªk,
§Y¥ý±N§ÜÅé©ñ¤Jmicro titer plate¤¤, ¨Ï»P¤º¾ÀªþµÛ, ¦A¥Hdiluitng
buffer³B²z, ¨Ï¥¼³QªþµÛªº¾À¤£·|±µ¨ü§Ü¤¸,
¦A¥[¤J§Üì©l»P§ÜÅé§@¥Î, ¦A¬~¥h¦h¾lªº§ÜÅé,
¦A¥[¤J¤w»Î±µ酶ªº§Ü¤¸, ¦A¬~¥h¦h¾lªº,
¦A¥[¤J酶ªº§@¥Îª«¨Ï²£¥Í¤ÏÀ³.
ª½±µªkªº¯ÊÂI¬O·Q´úªº¦³±M¤@©Êªº§Ü¤¸¶·»P¨ä¥LÂø½è¤¬ª§ªþ©ó¤º¾À,
¥HP¦³®É¶q¤Ö, ¦Ó¶¡±µªk«h¥i¿ï¾Ü©Êªº¯d¤U¨ü´úªº§Ü¤¸.
2.
¦Ü©ó§ÜÅé,
¥i¥H¥Î§Ü¤¸°t¦Xadjuvat¤@¦Pª`®g¤JÅ餤, 4¶g«á¦A¼W±jª`®g¤@¦¸,
2¶g«á¦A¼W±j¤@¦¸, ¥H«á¨C¦¸©â¦å«e7¤Ñª`®g¤@¦¸§Y¥i¨ú±o§t¦¹§ÜÅ骺¦å²G.
¦¹¦å²G¸gÂ÷¤ß, «O¦s¦å²M, ¦A¥Hammonium sulfate¨I¾ý§ÜÅé(¬ù33¢Mªº¿@«×§Y¥i¨I¾ý¥XIgG),
¦AÂ÷¤ß, «O¦s¨I¾ýª«, ¦A³zªR¥hÆQ, §Y¥i±o§ÜÅé.
³\¦h°ò¦]¥\¯à±±¨î¨ü¨ì»P¦¹°ò¦]¤¤¬Y¤@¤ùÂ_»P¬Y¯S®í³J¥Õ½èªºµ²¦X¤§¼vÅT,
¬°¬ã¨s¦¹ºØÃö«Y¦Ó¬ãµo¥X¤@¨Ç§Þ³N. n¬ã¨s¦¹¤@¥DÃD,
º¥ý¥²¶·¥ý¶i¦æ²ÓM®Ö»P²ÓM½è¤¤ª«½èªº©â´£.
²ÓM®Öª«½è©â´£
§÷
®Æ¡G
÷¨ÅÃþ°Êª«²ÓM(¥i¥Î²Õ´°ö¾i²ÓM¦pHela)
PBS
Hypotonic
buffer
Low-salt
buffer
High-salt
buffer with 1.2M KCl
Dialysis
buffer
Liquid
nitrogen
¬Á¼þ»sDounce
homogenizer
Dialysis
membrane tubing (¤Õ¬}¤À¤l¶q¡Ø14,000)
¾É¹q´ú¶q¾¹
¤è
ªk¡G (¦¹¤èªk§¡¦A4¢J¶i¦æ)
1.
»Ý¥Î5~10¡Ñ108cells/literªº²Õ´°ö¾i²ÓM,
¥H250mlÂ÷¤ßºÞ, Â÷¤ß20min, 4,000rpm. (Y¬°monolayer²ÓM,
À³¥H¶ì½¦¨í¤M±N²ÓM¨í¤U©ñ¤JÂ÷¤ßºÞ¤¤, ²ÓMn¥ý¥HPBS¬~¹L¦b¨í¤U.)
Ë¥h¤W²M.
2.
¦ôp¨I¾ýª«¤§¤j²¤Åé¿n,
¥[¤JÅé¿n¶q5¿ªºPBS, ²V¦X«á, Â÷¤ß10min, 4,000rpm, Ë¥h¤W²M.
3.
±N¨I¾ý²ÓM·»©óhypotonic
buffer(¬ù¨I¾ýÅé¿n5¿¶q), Â÷¤ß5min, 4,000rpm, Ë¥h¤W²M.
¦¹¤@¨BÆJ°Ê§@n§Ö, ¥H§K²ÓM¯}µõ·l¥¢©â´£ª«½è.
4.
¥[¤Jì¨I¾ý²ÓMÅé¿n3¿ªºhypotonic
buffer, ¸m¦B¤W10min, (¦¹¥~ì¨I¾ýÅé¿n¯d¦b²Ä¤G¨BÆJ®É©Ò±oÅé¿n,
¦]¦b²Ä¤T¨BÆJ®ÉÅé¿n¦]²ÓM¿±µÈ¦Ó¼W¤j¤F).
5.
±N²ÓMˤJDounce
homogenizer, ¤W¤UÀ£º^²ÓM(³B²z®É, °Ê§@»´, ¥H§K¶Ë¤Î²ÓM®Ö).
6.
±N§¡½è«áªº²ÓMˤJÂ÷¤ßºÞ,
Â÷¤ß15min, 4,500rpm, ¤À¶}«O¯d¤W»´»P¨I¾ýª«¤GªÌ.
¤W²M¥Î©ó©â´£²ÓM´Óª«, ¨I¾ýª«¥Î©ó©â´£²ÓM®Ö¤ºª«½è.
7.
¦ôp¨I¾ýª«Åé¿n,
¥[¤J¬ùÅé¿n1/2¿ªºlow-salt buffer, µM«á¤@ÃäÅÍ©Õ,
¤@Ãä¤@ºw¤@ºw¥[¤Jhigh-salt buffer, ª½¨ì¬ù1/2ªº¨I¾ýª«Åé¿n¬°¤î.
8.
½w½w®¶°Ê,
30min, ¦AÂ÷¤ß15,000rpm, 30min, ¤W²M²G´N¬O®Ö¤ººé¨ú²G.
9.
±Nºé¨ú²G©ñ¤J³zªR½¤¤º,
¥H50¿²G³zªR, ª½¨ì¥i¥H¾É¹q¾¹¶q¥X³U¤º¥~¤§¾É¹q«×¬Û¦P¬°¤î.
(2ml¥H¤U¶q¬ù1hr, 100ml¬ù5hr)
10.¨ú¥Xºé¨úª«,
Â÷¤ß15,000rpm, 20min, «O¯d¤W²M. ¥Î¤p¶q´ú³J¥Õ½è¿@«×,
¨ä¾l«O¦s¦b-70¢J.
±µµÛ±N«ez¨BÆJ6¤¤ªº¤W²Mª«,
¥Î¨Ó´£¨ú²ÓM½èºé¨úª«.
§÷
®Æ¡G
10x
cytoplasmic extract buffer
¤è
ªk¡G
1.
¨ú²ÓM½è(¤W²M²G)¶q0.11¿Åé¿nªº10x
cytoplasmic extract buffer¥[¤J²V¦X.
2.
Â÷¤ß16,000rpm,
1hr, ±N¤W²M²GˤJ³zªR½¤¤º, ¦Ü½¤¤º¥~¾É¹q«×¬Û¦P¬°¤î.
3.
¨ú¥Xºé¨úª«,
Â÷¤ß15,000rpm, 20min, «O¯d¤W²M, «O¦s©ó-70¢J.
°t¤è¡G
10x
cytoplasmic extract buffer¡G
0.3M
HEPES, pH7.9, 4¢J
1.4M
KCl
0.03M
MgCl2
Dialysis
buffer¡G
20mM
HEPES, pH7.9, 4¢J
20¢Mglycerol
0.2mM
EDTA
0.2mM
PMSF (phenyl methylsulfonyl fluoride)
¡°
¦¹¤Æ¦Xª«·»©óisopropanol,
À³¥ý½Õ0.2MªºÀx¦s²G³Æ¥Î, ¦b¨Ï¥Î«e¤~ºw¤J.
0.5mM
DTT (Dithiothreitol)
¡°
¥²¶·¨Ï¥Î«e¤~¥[¤J.
High
salt buffer¡G
20mM
HEPES, pH7.9, 4¢J
25¢Mglycerol
1.5mM
MgCl2
0.8, 0, 1.2, 1.4©Î1.6M KCl (¥Î©ó´ú¸Õ¦óºØ¿@«×¤U¥iµÑ¨ú³Ì°ª¶qªºª«½è,
YµL¨¬°÷®É¶¡, ¨ú1.0©Î1.2M¸Õ¤§)
Hypotonic
buffer¡G
10mM
HEPES, pH7.9, 4¢J
1.5mM
MgCl2
10mM
KCl
0.2mM
PMSF (¨Ï¥Î«e¥[¤J)
0.2mM
DTT (¨Ï¥Î«e¥[¤J)
Low
salt buffer¡G
°t¤è¦Phigh
salt buffer, ¦ÓKCl¥Î0.02M§Y¥i.
ªþµù¡G
1.
¥H¦¹¤èªk´ú±oµ²ªG¬ù8mg/ml²ÓM³J¥Õ½è.
2.
°µDNA-Protein¥æ¤¬§@¥Î¬ã¨s,
¤èªk¬°±N®Ö©Î²ÓM½è´£¨ú¤§³J¥Õ½è»P·Q¬ã¨sªºDNA¤ùÂ_µ²¦X,
¨Ã¥H¹qªa³B²z, ¨üµ²¦XªºDNA·|¶]±oºC. ¥t¥~, ¥ç¥i¥HDnase I³B²z,
¤Z¦³µ²¦XªºDNA¤£¨ü¤Á³Î, ¤èªk«Ü¦h, ®e«á¦A¤¶²Ð.
»Ã¥Àµß¬O¯u®Ö²ÓM°ò¦]¤uµ{ªº°ò¥»¬ã¨s¤u¨ã,
¦³¦pE.Coli¤§©óì®Ö²ÓM¤@¯ë.
»Ã¥Àµß(baker's
yeast)¦b°ö¾i²G¤¤, ¬ù90¤ÀÄÁ¤Àµõ¤@¦¸, ¥B¦b¦³®ñ,
µL®ñÀô¹Ò§¡¥i¦¨ªø.
»Ã¥Àµß¦³16Óª½½u«¬¬V¦âÅé(³æ®M),
³Ì¤pªº200Kb, ³Ì¤jªº2,200Kb, ¥B¦³Ãö¬V¦âÅé½Æ»sªº°_©lÂI(Origins
of replication) (ARS elements), ¤¤¤ß²É(centromeres, CEN elements)¤Î¥½ºÝ¬q(telomeres)§¡¤w³Q¶ù±µ¥X¨Ó.
¨ätelomeres§t¦³5dG-3dT3ªº«½Æ¤ù¬q.¦P®É¤H¤u¬V¦âÅé¤]¥Ñ¦¹¿»s³y¥X¨Ó,
¦Ó¥B¤]³]p¦¨¥i¥H¦bE.Coli¤Îyeast¤¤§¡¥i¦¨ªøªºshuttle vectors(¤Ú¤h¶ù±µ´C¤¶).
»Ã¥Àµß¥i¤À¦¨£\©Îa«¬,
³æ®M»Ã¥Àµß¥i¤Àªc£\©Îa³J¥Õ½è¨Ó»¤¾É"¥æ°t"¦¨Âù®M.
»Ã¥Àµß¦³ªº¤]§t¦³½èÅé,
¦³ªº¥ç§t¦³¯f¬r.
»Ã¥Àµßªº¦¨ªø,
¦b°ö¾i²G¤¤¹F¨ì5¡Ñ107cells/ml~2¡Ñ108cells/ml¬°¹¡©M,
³q±`¥ÎYPD(teast extract, peptone, dextrose)©ÎºÙYEPD medium.
YPD
medium°t¤è¡G
¨C¤½¤É§t10g
teast extract
20g
peptone
20g
dextrose
«O¦steast,
¥i¥Î¨C¤ä§t1mlªº30¢Mglycerol(®ø¬r¹L)¸ÕºÞ, ¥[¤J1ml yeast²G,
«O¦s¦b-70¢J, ©Î1ml yeast²G¤¤, ¥[¤J80£glªºDMSO, «O¦s¦b-70¢J.
¥Hµµ¥~½u¨ú±o»Ã¥Àµß¬ðÅܺØ
§÷
®Æ¡G
YPD
medium¤Îplates
¿ï¾Ümutantsªºplates(¦Û¦æ³]p)
©Î¥H·Å«×¿ï¾Ütemperature
sensitive metants
UV¿O(¨Ï¥ÎUV¿O®ÉÀ³À¹¦w¥þ²´Ãè)
¤è
ªk¡G
1.
±N¤@ºØyeastªø¦b5ml
YPD medium¤¤¹L©], 30¢J®¶Àú300rpm.
2.
¨ú1.5ml
yeast²G, ¥H·L¶qÂ÷¤ß¾÷, ³Ì°ª³tÂ÷¤ß5sec, Ë¥h¤W²M, ¦A¥HdH2O(®ø¬r¹L)¬~2¦¸.
¤§«á±N²ÓM·»©ó1ml dH2O¤¤.
3.
´úOD600,
Y¤¶©ó2.5~3.0, «h²ÓMz¤j¬ù¬°8¡Ñ107cells/ml,
±N²ÓM³v¦¸µ}ÄÀ¸m2,000cells/ml, ¦A¥H0.1ml¶î¥×.
4.
±N¶î¦³Yeastsªº¥×(«O¯d2Ó¬°¹ï·Ó²Õ),
¸mUV¿O¤U, ·Ó¨Ï¹F300eg/mm2, ¦A©ñ«Ç·Å, ªø3¤Ñ.
¹ï·Ó²Õ¬°´ú¨ä¥Í¦s¤§¥Î.
5.
¨ú®ø¬r¹Lªº¶ê§ÎÂo¯È,
°µreplica-plate, ±N¤@ӥשñ«Ç·Å, ¤@Ó©ñ37¢J, ªø3¤Ñ.
¤Z¦b«Ç·Å¦³ªø¦Ó37¢J¤£ªøªº¥i¯à´N¬Otemperature sensitive colonies,
¦¹¤@¨BÆJ©Î¥H§ÜÃĩʨӿï¥X§ÜÃĩʬðÅܺإç¦P.
Yeastªº¶ù±µ´C¤¶
¦³¨Çyeastªº¶ù±µ´C¤¶(cloning
vector)¬°plasmids, ºÙ¬°YRP(yeast replicating plasmids), ¨ä¤¤§t¦³yeast DNA½Æ»s°_©lÂIªº¤ù¬q°ò¦],
ºÙ¬°ARS(autonomous replication sequences), ¦ý³oºØplasmids¦bÁc´Þ¹Lµ{¤¤±`¤£¯à«O¦s¦b·sªº²ÓM¤¤,
Y¦b¦¹plasmids¤¤¥[¤JCentromeres(CEN elements), ¦Ó§Î¦¨YCP(yeast
centromeric plasmids), ´N¥i¨Ï¨äéw©Ê¼W¥[.
¥t¦³YEP(yeast
episomal plasmids), ¬O¥Ñyeastªºplasmid©Òºc¦¨. ÁÙ¦³YLP(yeast linear
plasmids)¬Oª½½u«¬ªº, ¦]§t¦³telomeres, ÁÙ¦³yeast artificial
chromosome(p YAC), ¥i¨Ñ¶ù±µ¬ù400KbªºDNA. ¦¹plasemid¨Ã¥iªø¦bE.Coli¤¤.
¦b³o¨Ç¶ù±µ´CÅ餤,
¬°«K©óÀË´ú¯S©w°ò¦]ªº¥\¯à, ±`¦b¦¹¯S©w°ò¦]¥[¤WLac 2 gene,
¦¹°ò¦]«Y¦]E.Coli¤¤±o¨Ó, ·|²£¥Í£]-galactosidase, ·í¦¹
¹J¨ì¤@¨ÇÃþ¦ü£]-galactosidesª«®É,
·|¤À¸Ñ¤§¦Ó²£¥Í¦³ÃC¦âªº¤À¸Ñª«, «Ü®e©ö°»´ú.
¬°¨Ï¦¹°ò¦]¯à¦byeast¤¤¹B§@, ¦b¦¹°ò¦]«e»Ý¥ý¥[¤Wyeastªºpromoter
region, ¥H¤U¤¶²Ð¤@ºØ´ú£]-galactosidase¶qªº¤èªk.
¦¹ªk¬O°ò©ó§t¦¹°ò¦]ªºyeast,
ªø©ó°ö¾i²G¤¤, ¥[¤JONPG(O-nitrophenyl-£]-D-galactoside), ¨Ï¦b30¢J§@¥Î,
¦A¥Hºw©w¨ÏpH¹F11²×¤î¤ÏÀ³, ¦A¥H¥úÃлö´ú¦â«×ÅܤƦÓpºâ£]-galactosidaseªº¶q.
§÷
®Æ¡G
YPD°ö¾i²G
Z
buffer
0.1¢Msodium
dodecyl sulfate (SDS)
chloroform
4mg/ml
ONPG in 0.1M KPO4, pH7.0 (¹LÂo®ø¬r, «O¦s-20¢J)
1M
NaCO3
30¢J
Water bath
¤è
ªk¡G
1.
¥H¤@ӵ߸sªº¯Âyeast±µºØ©ó5mlªºYPS²G¤¤,
¹L©](¥i°µ¤G, ¤Tӵ߸s¥H«K¤ñ¸û).
2.
¥H¹L©]°ö¾iªºyeast²G50£gl±µºØµLµßªºYPD²G5ml, ¨Ïªø¦ÜOD¡×2.0(¤j¬ù0.5~1¡Ñ108cells/ml).
3.
Â÷¤ß2,500rpm,
5min, (®à¤W«¬Â÷¤ß¾÷), ±N¨I¾ýª«·»©óµ¥¶qZ buffer¤¤. (¦pªG£]-galactosidase¶q¤£¦h,
¥i¥H·»©ó¸û¤Ö¶qªºZ buffer¤¤).
4.
¥Ñ¤Wz¨BÆJ¤¤¤§yeast,
¨ú¥X¤GӼ˥», ¤@¬°100£gl²ÓM¥[900£gl Z buffer, ¥t¤@¬°50£gl²ÓM¥[950£gl Z buffer.
5.
¦b¨C¤@¼Ë¥»¤¤¦U¥[¤J1ºwChloroform¤Î2ºw0.1¢MSDS²G,
vortex 10sec, ¦A©ñ¤J30¢J¤ô¯D¤¤15min.
6.
¦b¨C¤@¼Ë¥»¤¤¥[¤J0.2mlªº4mg/ml
ONPG, vortex 5sec, ¨Ã©ó30¢J¤ô¯D¤¤, ¨Ã¶}©lp®É.
7.
µo²{¦³¶À¦â¥X²{®É,
¥[¤J0.5mlªº1M Na2CO3¨Ã°O¤U®É¶¡.
8.
Â÷¤ß5min,
2,500rpm, ¦b´ú¤W²M²GªºOD420»POD550(Y¤W²M²G¤¤¤£§t²ÓM¯}µõª«,
«hOD550³q±`¬°0, ¥i¥H¤£pºâ).
9.
¨Ì¤U¦C¤½¦¡pºâ£]-galactosidaseªº¶q(³æ¦ìunit,
U)
¡@ 1,000¡Ñ¡eOD420(1.75¡ÑOD550)¡f t¡ÑV¡ÑOD600
![]() ¡@
¡@
U¡×
t¡×§@¥Î®É¶¡(min)
V¡×¨Ï¥Î©ó´ú©wªº°ö¾i²G¶q(ml)
OD600¡×¥Î©ó´ú©w¤§²ÓM¶q
OD420¡×O-nitrophenolªº§l¥ú¶q¤Î²ÓM¯}µõª«ªº§é¥ú¶q
OD550¡×²ÓM¯}µõª«ªº§é¥ú¶q
°t¤è¡G
Z
buffer¡G
16.1g
NaHPO4, 7H2O (60mM³Ì²×¿@«×)
5.5g
NaHPO4, H2O (³Ì²×¿@«×40mM)
0.75g
KCl (10mM³Ì²×¿@«×)
0.246g
MgSO4, 7H2O (³Ì²×¿@«×1mM)
2.7ml
£]-mercaptoethanol (50mM³Ì²×¿@«×)
½Õ¾ãpH¦Ü7.0,
¦A¥HdH2O¥[¦Ü1¤½¤É, ¤£n°ª·Å°ªÀ£®ø¬r.
ªþµù¡G
·í£]-galactosidase¤À¸ÑONPG¦¨¬°O-nitrophenol»Pgalactose,
¦Ó«eªÌ¬°¶À¦â, ¥i¥HOD420´ú¥X. ¦Ó·í©Ò§ë¤JªºONPG¶q¦h®É,
¦¹¤ÏÀ³»P酶ªº¶q¦³¬Û¦P©Ê.
»Ã¥Àµß°ò¦]Âà´Ó
¥Ø«e±N°ò¦]Âà´Ó¤Jyeast¤¤,
¥Dn¦³¹q¤lºj, ¹q·¥, lithium acetate¤Îspheroplastsµ¥ªk,
¦¹³B¶È¤¶²Ðlithium acetateªk. ¦¹ªk¬O°ò©ó¶§Â÷¤l¥i¨Ïyeastªº²ÓM½¤¯à¨ÏDNA³z¹L,
¦b¥[¤JDNA«á, ¦A¥[¤Jpolyethylene glycol(PEG),
¦A¶î¦b¿ï¾Ü©Êªº°ö¾i¥×¤W.
§÷
®Æ¡G
YPD
medium
TE
buffer
Lithium
autate solution
5mg/ml
carrier DNA (sheared E.Coli DNA)
PEG
solution
§t¿ï¾Ü©Ê¤Æ¾Ç«~ªº°ö¾i¥×
¤è
ªk¡G
1.
±N¯Â¤Æªº³æ¤@µß¸syeast¥[¤J2ml
YPD²G¤¤, ¦b30¢J¦¨ªø¤@±ß.
2.
±N²ÓMµ}ÄÀ¦ÜOD600¡×0.2(¬ù3¡Ñ106cells/ml)¨ú50ml
YPD(§t¤Wz¶q¤§yeast)©ó250À@§Î²~¤¤¨Ïªø4hr, 30¢J, ¨Ï¹FOD600¡×0.5~1.0(¬ù1~2¡Ñ107cells/ml),
(¨Ï¥Î®É¬ù10ml¥i°µ¤@Ó¹êÅç).
3.
±N²ÓMÂà¤JµLµßÂ÷¤ßºÞ,
Â÷¤ß2,500rpm, 10min, Ë¥h¤W²M, ±N²ÓM·»¦b10mlªºlithium acetate²G¤¤.
4.
¦AÂ÷¤ß2,500rpm,
10min, Ë¥h¤W²M, £glªºlithium acetate²G¤¤.
5.
±N²ÓM²ÅÄa²GÂà¤J¤@¤ä®ø¬r¹Lªº13¡Ñ100ml¸ÕºÞ¸m30¢J,
»´»´®¶Àú50rpm, 1hr.
6.
±N100£glªº¤Wz²ÓM¯BÄa²G¥[¤J·L¶qÂ÷¤ßºÞ¤¤(¤@¦@¥i¦³5¤ä),
°£±±¨î²Õ¨º¤ä¥~, ¨ä¾l¦U¥[¤J10£ggªºDonor DNA¤Î20£ggªºcarrier DNA(«OÁ`Åé¿n¤£n¦h©ó15£gl).
¹ï±±¨î²Õ«h¥u¥[¤Jcarrier DNA, ±N²GÅé¥Hpipettor¤W¤U©â§l²V¦X. ¸m30¢J,
30min.
7. ¨C¤ä¸ÕºÞ¥[¤J0.7ml PEG²G, ¥H¤â«ü»´¼u¸ÕºÞ²V¦X¤§, ¸m30¢J, 45min, ¦A¸m42¢J, 5min.
1.
±N¨C¸ÕºÞ¤º§l¥X200£gl¶î¿ï¾Ü©Ê¥½L, ¸m30¢J, 2¤Ñ, ¥i¬Ýµ²ªG.
2.
±N¦A¿ï¾Ü©Ê¥½L¤Wªº¤ÀÂ÷µßºØ,
¨ú¼ÆÓ, ¤À§O°ö¾i©ó°ö¾i²G¤¤, ¥H«K«O¦s.
°t¤è¡G
lithium
acetate solution¡G
0.1M
lithium acetate
10mM
Tris.Cl, pH8.0
1mM
EDTA
¥H¹LÂo®ø¬r
PEG
solution¡G
40¢M(w/v)
PEG3350
0.1M
lithium acetate
10mM
Tris Cl, pH8.0
1mM
EDTA
¹LÂo®ø¬r
ªþµù¡G
¦¹ºØ¤èªk¥i±o¬ù¨C£gg DNA, ¦³1~10Ó²ÓM¥iÂà´Ó¦¨¥\.
©â´£»Ã¥ÀµßDNA
¥H¤U¤¶²Ð¥HZymolase³B²zyeasts,
¨Ï¦¨¬°spheroplasts, ¦A¥HSDS¨Ï¯}µõ, ¦A¥Hpotassium acetate±NSDS,
proteins¤Îcellular debris¨I¾ý, ¦Ó®Ö»Ä«h«O¯d¦b¤W²M²G¤¤,
³oºØ¤èªk¨Ó©â´£yeastªºDNA.
§÷
®Æ¡G
YPD
medium
Sorbitol
solution
0.3mg/ml
Zymolase (20,000U/g) in sorbitol solution
0.28M
£]-mercaptoethanol
Tris/EDTA
solution
10¢MSDS
5M
Potassium acetate
100¢Methanol
TE
buffer
1mg/ml
RNase A
100¢Misopropanol
15ml
Â÷¤ßºÞ(¥Î¹L§Y±ó¦¡)
30¢J¤Î37¢J®¶Àú°ö¾i¬Û
65¢J¤ô·»¾¹
¤è
ªk¡G
1.
¦b15mlµLµßÂ÷¤ßºÞ¤¤,
°ö¾i5mlªº¯ÂyeastµßºØ(¥Ñ³æ¤@µß¸s±µºØ), 30¢J, ®¶Àú°ö¾i24hr, 350rpm, ¦¹®É²ÓM¼Æ¬ù1~2¡Ñ108cells/ml.
2.
Â÷¤ß3,000rpm,
5min, ±N¤W²M²G§l°£.
3.
¥[¤J0.5ml
sobitol solution, ¥R¤À²V¦X.
4.
¥[¤J5£glªº0.3mg/ml
zymolase in sobitol solution, ¥H¤Î50£glªº0.28M £]-mercaptoethanol, ¥R¤À²V¦X(votex), ¸m37¢J,
1hr, ®¶Àú200rpm.
5.
Â÷¤ß3,000rpm,
5min, §l°£¤W²M, ¥[¤J0.5ml Tris/EDTA²G,
±N²GÅé§l¤W§l¤U¥H¥R¤À²V¦X, ¦A±N¥þ³¡²GÅé(§Y²ÓM¯BÄa²G)Âà¤J1.5mlªº·L¶qÂ÷¤ßºÞ¤¤.
6.
¦A¥[¤J50£glªº10¢MSDS²G,
½w½w²V¦X, ¸m65¢J, 20min.
7.
¦A¥[¤J200£glªº5M potassion acetate, ½w½w²V¦X, ¸m¦B¤W30min.
8.
Â÷¤ß10,000rpm,
3min.
9.
±N¤W²M²GÂà¤J¥t¤@Â÷¤ßºÞ¤¤,
¦A¥[¤J100¢Methanol¸mÂ÷¤ßºÞ, ½w½w²V¦X. (¦¹®ÉDNA·|¥X²{)
10.Â÷¤ß10,000rpm,
10sec, ¨I¾ýDNA, Ë°£¤W²M, ±NDNA·»©ó300£gl TE¤¤.
11.¥[¤J50£glªº1mg/ml
Rnase A, ¥R¤À²V¦X, ¸m37¢J, 1hr.
12.¥[¤J0.5mlªº100¢Misopropanol,
½w½w²V¦X, ¦ÜDNA¨I¾ý¥X¨Ó.
13.±NDNA¥H·L¶q§lºÞ¦yÀY¨ú¥X,
¨ÃÂà¤J¥t¤@·sÂ÷¤ßºÞ¤¤, ¥[¤J125£glªºTE buffer.
°t¤è¡G
Sorbitol
solution¡G
0.9M
sorbitol
0.1M
Tris,Cl, pH8.0
0.1M
EDTA
Tris/EDTA
solution¡G
50mM
Tris,Cl, pH8.0
20mM
EDTA
ªþµù¡G
¦b©â´£yeast
DNA®É, plasmids¤]·|¤@¦PªR¥X, ¨ä¶q¤j¬ù¬Oyeast DNA¶qªº1/1,000,
¥ç§Y¦b2mlªºyeast cells¥i´£¥X¬ù4£ggªºDNA, ¦Ó¨ä¤¤plasmids¬ù¦³4ng,
¥iª½±µ¥Î¨ÓÂà´Ó. (¥un¥Î0.1£ggªºDNA§Y¥i,
¨ä¤¤¬ù§t0.1ngªºplasmeds)
.¥|¤Q¤@.°ò¦]´Ó¤J°Êª«²ÓM§Þ³N
¦¹³Bºò¤¶²Ð³Ì±`¥Îªº¤èªk,
¨Ã¥H²Õ´°ö¾i¤§³æ¼h²ÓM¬°¼Ðªº.
²Õ´°ö¾i°Êª«²ÓM,
À³ª`·NµLµß§Þ³N, ¬°¨Dªì¾ÇªÌ·»²GµÛ¤â, ¥HHela²ÓM,
§Y¥i°ª·Å°ªÀ£®ø¬rªºMEM°ö¾i²G¶}©l, ¥[¤J10¢Mªº¤û¦å²M.
¨Ã¥[¤JGentamicin sulfate(§Ü¥Í¯À), ¥H¨¾¦Ã¬V.
¦b²ÓMéÂ÷°ö¾i¾¹®É, ±Ä¥Î0.5¢Mw/vªºtrypsin§Y0.2¢Mw/vªºEDTA²G,
©Ò¦³ªº°ö¾i²G, ¦b¨Ï¥Î«e, ¥²¶·¥ý©â¥X¤Ö¶q, ¥ý¦bCO2«í·Å°ö¾i¬Û¤¤°ö¾i¦Ü¤Ö2¤Ñ,
µL¦Ã¬V¥X²{, ¤~¯à¨Ï¥Î. ¦b±q¨Æ°ò¦]´Ó¤J°Êª«²ÓM§Þ³N«e,
À³¥ý¼ô±x°Êª«²Õ´°ö¾i, §Y¥Íªø¦±½u¬°¥²n¤§½m²ß. ¨C4¤p®É,
¥Ñ12¶ê¹j°ö¾i½L¤¤, ¨ú¥X¤@¹j¤§²ÓMp¼Æ, ¦Ü72¤p®É¬°¤î.
ÂǦ¹½m²ß¨Ó¼ô±xµLµß§Y°ö¾i§Þ³N.
¥HCalcium
Phosphate¨I¾ýDNA©óHEPES½w½Ä²G¤¤¨Ã¨ÏDNA´Ó¤J°Êª«²ÓMªk¡G
§÷
®Æ¡G
¥Íªø´ÁHela²ÓM
°ö¾i²G
½èÅéDNA(§t¯à¦b°Êª«²ÓM¤¤ªí²{¤§¥i±´´ú°ò¦])(¨C¦¸Âà´Ó»Ý10~50£gg DNA)
2.5M CaCl2
2x
HEPES-buffered saline (Hebs)
[°t¤è]16.4g
NaCl
11.9g
HEPES acid
0.21g
Na2HPO4
800ml
dH2O
¥H5N
NaOH½Õ¾ãpH¦Ü7.05
¥H0.45£gmÂo½¤¹LÂo®ø¬r, ¤À§O¥Î50ml¶q«O¦s¦b-20¢J
ª`·N¡G¦¹®É¥²¶·±N0.5ml¤§2xHeBS»P0.5ml¤§250mM
CaCl2²V¦X, ¬Ý¦³§_¨I¾ýµo¥Í, ¦pµL«Ü²Óªº¨I¾ý,
«h®ÄªG¤£¨Î.
Phosphate-buffered
saline (PBS)
[°t¤è]
10X«O¦s²G°t¤è¡G
80g
NaCl
2g
KCl
11.5g
Na2HPO4 7H2O
2g
KH2PO4
1Xªº¨Ï¥Î²G°t¤è¡G
(pH¬ù¬°7.3)
137mM
NaCl
2.7mM
KCl
4.3mM
Na2HPO4 7H2O
1.4mM
KH2PO4
37¢J,
5¢MCO2«í·Å°ö¾i½c
10cm²Õ´°ö¾i¥×
15mlµLµßconical
tube
¤è
ªk¡G
1.
¦bÂà´Ó«e¤@¤é,
±N²ÓM±µºØ¤J°ö¾i¥×, ¬ù1¡G15¤ñ²vµ}ÄÀ§¹¥þº¡§Gªº²ÓM, ¥[¤J9ml°ö¾i²G.
2.
±NnÂàȱoDNA,
¥H°sºë¨I¾ý, ¨Ã´½°®, ¦A·»¤J450£glªºµLµß»]ÃH¤ô¤¤,
¦A¥[¤J50£gl¤§2.5M CaCl2.
(¦¹³B¥H°sºë¨I¾ýDNAªº¥Øªº¦b®ø¬r)
3.
¦b¤@Ó15mlªºconical
tube¤¤¥[¤J500£glªº2X HeBS,
¦¹®É¤@±¥H¤@ÓµLµß1£gl§lºÞ¦V¦¹²G¤¤¥´®ð,
¤@±¤@ºwºwªº¥[¤JDNA/CaCl²G, ¥[§¹«á¥ß§Yvotex 5¬íÄÁ.
4.
¸m«Ç·Å20min.
5.
±N¦¹DNA¨I¾ý²G§¡¤Ã¤À¥¬¦b²Õ´°ö¾i¥×¤§²ÓM¤W.
6.
°ö¾i6¤p®É,
Ë¥h°ö¾i²G, ¥H5ml¤§1X PBS¬~²ÓM2¦¸, ¦A¥[¤J10ml°ö¾i²G.
7.
Y¬°¼È®É©ÊªºÂà´Ó,
¹j¤é§Y¥i¨ú¤UÀË´ú. Y¬°°ö¾iéw¤§Âà´Ó²ÓM,
«h¥O²ÓMªø¤G¦¸¤Àµõªº®É¶¡, ¦b«O¦s¤§.
¹w´Áµ²ªG¡G¬ù10¢Mªº²ÓM¥i³QÂà´Ó.
ªþµù¡G
¬°¯à°»´ú°ò¦]¦³§_´Ó¤J²ÓM,
"¥i±´´ú°ò¦]"¦p£]-galactosidase, ©Î¿Ã¤õÂΤ§luciferase°ò¦]§¡¥i¨Ï¥Î.
¦b¦¹¤§«e,
¥»¤â¥U¼h¤¶²Ð±N°ò¦]Âà´Ó¤J²Óµßªº¤èªk,
·í®É©Ò¨Ï¥Îªº¬°§Ö³t²©öªk, ¦ý°ò¦]´Ó¤Jªº¦¨¥\²v·¥§C,
¦¹¥~¤]¤w¤¶²ÐCaCl2ªk, ¦b¦¹¤@¨Ã±N¨Ï¥ÎCaCl2¨ÓÂà´Ó²Óµßªº¤èªk¦C¥X,
¨Ñ°Ñ¦Ò¡G
§÷
®Æ¡G
LB°ö¾i²G
E.Coli¯Âµß
CaCl2²G
[°t¤è]60mM
CaCl2
15¢Mglyerol
10mM
PIPES, pH7.0 (¦pµLPIPES, «h¨ú¤W¤GºØ§÷®Æ°t»s)
¥i°ª·Å°ªÀ£®ø¬r.
LB°ö¾i¥×§tampicillin
Plasmid
DNA
¤è
ªk¡G
1.
±N¦¹µßE.Coli±µºØ©ó50ml
LB²G¤¤, ¹L©]37¢J, (250rpm)®¶Àú°ö¾i.
2.
¨ú¤WzE.Coli
4ml, ¥[¤J¦³400ml LB²G¤§1 literÀ@²~, 37¢J, 250rpm, °ö¾i6¤p®É.
3.
±N(2)¤¤ªºE.Coli¤À¸Ë¦bÂ÷¤ßºÞ¤¤,
¨C¤ä50ml, ¨Ã¸m¦B¤W10min, ¦AÂ÷¤ß5,000rpm, 5¤ÀÄÁ, 4¢J.
4.
±N²Óµß¨I¾ý¦A·»©ó10ml,
CaCl2²G¤¤, ¦A©ó4¢J, 5,000rpm, 5min.
5.
¦A±N²Óµß¨I¾ý·»©ó10ml
CaCl2²G¤¤, ¸m¦B¤W30min, ¦A4¢J, Â÷¤ß5,000rpm, 5min.
6.
¦A±NE.Coli·»©ó2ml
CaCl2²G¤¤, ¦A¤À¦¨250£gl¦Ü·L¶qÂ÷ºÞ¤¤.
¨Ã«O¦s¦b-70¢J, «Ý¥Î.
7.
¨ú¤@¤ä¶ê©³Â÷¤ßºÞ,
¸m¦B¤W,¥[¤J10¦Ü25£gl¤§plasmis DNA¬ù10ng, ¨ú¥X§Ná©ó-70¢Jªº²Óµß,
§Ö³t¦b37¢J¸Ñá, ¨ú¥X100£gl¥[¤J§tDNAªºÂ÷¤ßºÞ¤¤.
¸m¦B¤W, 10min.
8.
±N¦¹Â÷¤ßºÞÂà§ë¤J42¢J¤ô·»¤¤,
2min, ¥[¤J1ml¤§LB²G, ¦A©ñ37¢J, 250rpm, 1hr.
9.
±N¦¹Âà´Ó¹Lªº²Óµß,
µ}ÄÀ¼Æ¦¸, ¨C¦¸¥H¬Á´Î¶î¥½Lªk¶î¦b«í·Å°ö¾i½c,
¦Ü²Ä¤G¤éÀ˵øµ²ªG.
.¥|¤Q¤@.¨Ï¥Î°ò¦]ºjÂà´Ó°ò¦]
ª`·N¨Æ¶µ¡G
1.
¤Á¤Å±Nºj¤f¹ï¤H.
2.
¨Æ«e³Æ§´polyvinylpyrollidone(MW¡×360,000,100g¬ù750¤¸),
Spermidine(Sigma #S-0266, 5g¬ù3,500¤¸). 99.9¢M°sºë. 15ml»P1.5mlÂ÷¤ßºÞ,
0.05M Spermidine, 1M CaCl2, 20mg/ml polyvinylpyrollidone (·»©ó°sºë)
¨Ï¥Î«e¨ú¤Ö¶qµ}ÄÀ¦¨0.1mg/ml, ·Ç³Æ3.5ml¥H¨Ñ50µo¤l¼u¥Î,
3.
¨C50µo¤l¼u,
¥Î35mgª÷¯» (ª½±µ¸m¤JÂ÷¤ßºÞ´ú),
100£gg
DNA (¿@«×¡Ö1£gg/£gl). ºÞ¤lªø76cm. ¥H3.5ml²Gª¬¥R¶ñ.
4.
¤l¼u·Ç³Æ¬[¥ª¤è¦³2Ó¤p½¦°é(O-rings),
¤Îºj¼Q¤f¦³1Ó¤p½¦°é, ¥Î¤[¿i·l¶·§ó´«.
¨B
ÆJ¡G
(¨C50µo¤l¼u¥Î)
1.
±N35mgª÷¯»(ª½±µ¸m¤J1.5mlÂ÷¤ßºÞ´ú),
¥[¤J100£gl¤§0.05M Spermidine, vortex
5sec, sonicate 10sec.
2.
¥[¤J100£gg DNA(Y¦P®ÉÂà´Ó1ºØ¥H¤W°ò¦], µ¥¶q¥[¤J),
vortex 5sec.
3.
¥[¤J100£gl 1M¤§CaCl2, ¥H§C³tvortex 5sec,
¦A¸m«Ç·Å¨Ï¨H¾ý10min, Â÷¤ß4,000rpm, 15sec, §l°£¤W²M,
4.
¥[¤J1ml
99.9¢M°sºë, ¥H§C³tvortex 5sec, Â÷¤ß4,000rpm, 15sec, §l°£¤W²M, ¦p¦¹,
«ÂÐ3¦¸, §l°£¤W²M.
5.
¥[¤J0.1mg/ml¤§polyvinylpyrollidone
0.5ml, ¥H§C³tvortex 5sec, ±NºÞ¤ºª«¥þ³¡§l¤J15mlÂ÷¤ßºÞ¤¤, ¦A¥H0.1mg/ml¤§polyvinylpyrollidone
1ml¥[¤Jì1.5mlÂ÷¤ßºÞ¤¤, ¦A¥H§C³tvortex 5sec,
±NºÞ¤ºª«¦A¥þ³¡§l¤J15mlÂ÷¤ßºÞ¤¤, ¦A¥H0.1mg/ml¤§polyvinylpyrollidone
1ml ¥[¤Jì1.5mlÂ÷¤ßºÞ¤¤, ¦A¥H§C³tvortex 5sec,
±NºÞ¤ºª«¦A¥þ³¡§l¤J15mlÂ÷¤ßºÞ¤¤, ¦A©ó15mlÂ÷¤ßºÞ¤¤¥[¤J0.1mg/ml¤§polyvinylpyrollidone
1ml, ¦A¥H§C³tvortex¦¹15mlÂ÷¤ßºÞ5sec, ¦¹®É¥i±N¦¹ºÞ«O¦s©ó-20¢J.
©Î±µ¤U¦C¨BÆJ.
6.
±N¤l¼u·Ç³Æ¬[¦w¸m¦n,
¨Ã³q¤JN2, ±N76cm¤l¼uºÞ¥Ñ¥k°¼´¡¤J, ª½³q¦Ü¥ª°¼Àô¤º1cm,
±N´á®ð¶}Ãö½Õ¦Ü0.3~0.4, ¨Ã§j®ð¤JºÞ15min.
7.
Ãö±¼´á®ð¶}Ãö,
±NºÞ¨ú¥X, ±N¤@ºÝ´¡¤J±µ¦³³n±µÀYªº10ml°wµ©ºÞ,
±N¤l¼uºÞ¥t¤@ºÝ¸m¤J§t3.5ml¶Àª÷¯», DNAªº²GÅ餤(¦¹²GÅé»Ý¥ý¥H§C³tvortex
10sec, ¨âsonicate 30sec, ¨Ã¥ß§Y¨Ï¥Î), ¥H°wµ©§l¨ú²GÅé¦Ü¤l¼uºÞªø64cm³B,
±N¤l¼uºÞ¨ú¥X, ¦ý¬O¦A¥H°wµ©§l¤l¼uºÞ¤¤²GÅé,
¨Ï¤l¼uºÞ¨âºÝ§¡¯d¤U¬ù6cmªÅ¥Õ, ¥ß§Y±N¤l¼uºÞ´¡¤J·Ç³Æ¬[,
¨Ãµ¥5min, ¨Ïª÷¯»ÖߦbºÞ¾À, ¦A¥H°wµ©¥H2cm/secªº³t«×±N¤l¼uºÞ¤¤°sºë§l°£.
8.
¨ú¤U°wµ©,
±N·Ç³Æ¬[±ÛÂà¶}Ãö¥´¶}, ¨ÏÂà°Ê30sec, ¦A¥´¶}´á®ð,
¨Ï¤l¼uºÞ°®Àê5min, Ãö´á®ð, °±Âà, ±N¤l¼uºÞ¨ú¥X.
9.
Àˬd¤l¼uºÞ,
¬Ýª÷¯»¬O§_§¡¤Ã¤À§G, ±N¤£¨}³¡¥÷¥Hñ¦rµ§µù°O,
¥H«K¤Á¦¨¤l¼u®É±ó¤§.
10.±N¤l¼u«O¦s²°(§t°®À꾯)¸m¤Á¤l¼u¾¹¤U,
±N¤l¼uºÞ´¡¤J¤Á¤l¼u¾¹, ¶}©l¤Á¤l¼u,
§¹¦¨«á±N¤l¼u«O¦s²°¼Ð¥Ü²M·¡, »\¦n, ¨Ã¥Hparafilm«Ê¦n, «O¦s©ó4¢J.
¦b¨Ï¥Î«e±N¤l¼u¸Ë¤J¼u§¨, ±N¼u§¨¥H"12"¦V¤W¸Ë¦Ü©w¦ì.
11.±N®ó®ð±µ¦n,
½Õ¦Ü400psi, ³Ì¤j¦Ü600psi, ·Ç³Æ®gÀ». ®gÀ»«á, ¨ú¤U¼u§¨,
Ãö®ó®ðÁ`¶}Ãö, ±N®ó®ð½Õ¸`»Ö°f®É°wÂà, ±Æ®ð, ¦A©î¤U±µºÞ.
12.Y®gÀ»°Êª«ªþµÛ²ÓM,
§l°£°ö¾i²G«á¬°¤§, ¯BÄa²ÓM«h¥H5¡Ñ107cells/ml¿@«×, ¨ú20£gl, ºw©ó°ö¾i¥×¤W,
¨Ï¤À§Gª½®|¤p©ó1.5cm, Y®gÀ»°Êª«¥Ö¼h, ¥ý«c¥h¤ò, ¥Î70¢M°sºë®ø¬r«á¬°¤§.
Yn¥HRNA¨ú¥NDNA,
«h¤£¥ÎCaCl2, »Ppolyvinylpyrollidone¦Ó¥Î5M ammonium»P2-propanol¨Ó±NRNAªþ¦bª÷¯»¤W.
¨ä¨BÆJÃþ¦P³B²zDNA.
²z¦p¤U¡G
1.
¶q35mgª÷¯»,
¥[¤J²GÅémRNA, (5£ggRNA/mgª÷¯»), ¥[¤J²GÅémRNAÅéºÞ1/10¶qªº5M
ammonium»P2¿¶qªº2-propanol, vortex 15sec, Â÷¤ßÂ÷¤ß4,000rpm, 15sec,
§l°£¤W²M.
2.
¥[¤J1ml
99.9¢M°sºë, ¥H§C³tvortex 5sec, Â÷¤ß4,000rpm, 15sec, §l°£¤W²M.
3.
¥[¤J0.1mg/ml¤§polyvinylpyrollidone
0.5ml, ¥H§C³tvortex 5sec, ±NºÞ¤ºª«¥þ³¡§l¤J15mlÂ÷¤ßºÞ¤¤, ¦A¥H0.1mg/ml¤§polyvinylpyrollidone
1ml ¥[¤Jì1.5mlÂ÷¤ßºÞ¤¤, ¦A¥H§C³tvortex 5sec.
4.
±NºÞ¤ºª«¦A¥þ³¡§l¤J15mlÂ÷¤ßºÞ¤¤,
¦A¥H0.1mg/ml¤§polyvinylpyrollidone 1ml¥[¤Jì1.5mlÂ÷¤ßºÞ¤¤,
¦A¥H§C³tvortex 5sec.
5.
±NºÞ¤ºª«¦A¥þ³¡§l¤J15mlÂ÷¤ßºÞ¤¤,
¦A©ó15mlÂ÷¤ßºÞ¤¤¥[¤J0.1mg/ml¤§polyvinylpyrollidone 1ml, ¦A¥H§C³tvortex
¦¹15mlÂ÷¤ßºÞ5sec, ¦¹®É¥i±N¦¹ºÞ«O¦s©ó-20¢J. §Y¦¨.
°µ±Æ§Ç¥Î
»¡©ú¡G
1.
¦¹»ö¾¹±Ä¹p®g¥ú°»´ú¦b¤ò²ÓºÞ¹qªa¤¤,
¤£¦PÃC¦â¼Ð©w¤§ddNTP®Ö»Ä¦X¦¨¤¤Â_ªk¤§ÃC¦â,
¦Ó¥H¹q¸£³nÅé§PŪ±Æ§Ç. ABI 310¦b¨Ï¥ÎBigDye Terminator Cycle
Sequencing Ready Reaction Kit®É, ±ÄE«¬Âo¥ú¼Ò¦¡°»´ú.
2.
¥Ø«e¥»®Õ±ÄÁÊ¥»ABI
310«¬®Ö»Ä¦Û°Ê±Æ§Ç»öªº¬ü°ÓÀ³¥Î¥Í©R¬ì¾Ç»ö¾¹¤½¥q¦³2ºØ®M²Õ¨Ñ®Ö»Ä¦Û°Ê±Æ§Ç»ö¨Ï¥Î,
¨ä¤@¬°ABI Prism BigDye Terminator Cycle Sequencing Ready Reaction Kit,
¥t¤@¬°ABI Prism BigDye Terminator Cycle Sequencing Ready Reaction Kit v2.0.
¨ä¤¤v2.0¥Î©ó¸ûªø¬qªº®Ö»Ä±Æ§Ç, ¦ý2ªÌªºprotocol §¹¥þ¬Û¦P,
§¡¥i¥Î©ó³æªÑ, ÂùªÑ, PCR¦¨«~µ¥¤§±Æ§Ç¤§¥Î, ±ÄÁʮɥHv2.0¬°¨Î.
3.
¤Wzkits¤¤,
Taq polymerase, bufferµ¥§¡¤v²V¦b¤@°_«K©ó¨Ï¥Î.
4.
Y»Ý³nÅ鳡¥÷,
¥i¥Ñhttp://www.pebio.com/ab/techsupp/310.html
download.
5.
ABI Prism BigDye Terminator Cycle Sequencing Ready Reaction Kit with
AmpliTaq FS v2.0, ¤À§O¦³¥i¨Ï¥Î100(±ÄÁʽs¸¹#4303149)¦¸, ©Î1,000(#4303150)¦¸µ¥¦hºØ.
¥i¨Ì¥Î¶q¿ïÁÊ, ¦¹KitÀ³«O¦s©ó-20¢J.
6.
¦btemplateªº¨Ï¥Î¶q¤W,°Ñ¦Ò¤Uªí:
PCR
product(¥²¶·¯Â¤Æ):
100~200bp
1~3ng
200~500bp
3~10ng
500~1000bp
5~20ng
1000~2000bp
10~40ng
>2000bp
40~100ng
Single-stranded
DNA 50~100ng
Double-stranded
DNA 200~500ng
Cosmid
or Bacterial artificial chromosome (BAC) 0.5~1.0£gg
Bacterial
genomic DNA 2~3£gg
7.
¾ãӱƧǥμ˳̲×Åé¿n¬°20£gl,
¥]¬A8£gl
DNA template, 4£gl
primer, primerªº¿@«×¬°0.8pmol/£gl, Y±Nprimerªº¿@«×´£°ª¬°4.2pmol/£gl, «h¥i¥u¥Î1£gl, ¦Ótemplate«h¥i¥Î¨ì11£gl. ¥t8£gl¬°Cycle sequencing mix.
8.
¥»»ö¾¹³nÅ駡¤w¥Ñ¼t°Ó¥N¬°¸Ë§´,
sequencing data collection©ó¹q¸£¶}¾÷§Y¥i¨Ï¥Î,
¦b¤ÀªR®É«h¥t¥H¤ÀªR³nÅé¦æ¤§. ¦³»Ý®Õ¹ï»ö¾¹®É, ¥i¥ÎABI 310
diagnostics system³nÅé, ¹ï¾ãÓ»ö¾¹®Õ¹ï¬ù»Ý9min. ±Æ§Ç§¹¦¨«á,
¥i¥ÎFactura Identification Software¾ã²zµ²ªG.
°õ¦æplasmids
»PPCR productsªºsequencing¨BÆJ¡G
¥ý°õ¦æCycle
sequencing, ¦b¥»®ÕªºRoboCycler 40«¬thermal cycler°õ¦æ. ¥Î0.5mlªºÂ÷¤ßºÞ,
¥[¤J¡G
Terminator
Ready Reaction Mix 8.0£gl
Template
¦p»¡©ú5
Primer¦p»¡©ú6
¤W3¶µ¦Xp20£gl,Y¤£¨¬,¥[¥hÂ÷¤l¤ô.
1.
¥R¤À²V¦X«á,
Â÷¤ß3,000rpm, 5sec, ¦A¥[40£gl mineral oil.
2.
µM«á¶i¦æ¤ÏÀ³96¢J
30sec, 50¢J 15sec, 60¢J 4min, 25cycles. µM«á¨ú¥X, Â÷¤ß3000rpm, 5sec.
3.
¦A¶i¦æ¯Â¤Æ(¨Ï¥ÎBio-Rad
Quantum Prep PCR Kleen Spin Columns ¡V¨BÆJ¬°¥ý±Ncolumn¤¤ªºresin½w³tvortex
10sec, ±N©³³¡´U¨ú¤U, ±Ncolumn¸m¤J1¤ä2.0mlÂ÷¤ßºÞ¤¤, Â÷¤ß750xg,
1min, ¦A±Ncolumn¸m¤J1¤ä1.5ml¤w°ª·Å°ªÀ£®ø¬r¹LªºÂ÷¤ßºÞ,
±Nn¯Â¤ÆªºDNA§l¤JºÞ¤¤, Â÷¤ß750xg, 2min, (³t«×¤£¥i¤Ó°ª,
®É¶¡¤£¥i¶W¹L2min) ©Ò±o§Y¬°¯Â¤ÆDNA).
¡°¦³Ãöxg´«ºâ¬°rpmªº°Ñ¦Ò¤½¦¡¦p¤U¡G
xg¡×1.12¡Ñ105¡Ñr
(r¬°¥Ñ¶b¤ß¦ÜÂ÷¤ßºÞ¥¿¤¤¶¡¤§¥b®|cmÈ¡Ñrpm2)
©Î
xg¡×11.18¡Ñr¡Ñ(rpm/1000)2
Y¬°BAC
DNA,«h¥Î0.5mlªºÂ÷¤ßºÞ,¥[¤J
Terminator
Ready Reaction Mix 16.0£gl
Template
¦p»¡©ú5
Primer
5~10 pmol
¤W3¶µ¦Xp40£gl, Y¤£¨¬, ¥[¥hÂ÷¤l¤ô.
1.
¥R¤À²V¦X«á,
Â÷¤ß3,000rpm, 5sec, ¦A¥[40£gl mineral oil.
µM«á¶i¦æ¤ÏÀ³25 cycles.
2.
µM«á¨ú¥X,
Â÷¤ß3000rpm, 5sec.
3.
¦A¶i¦æ¯Â¤Æ.
Y¬°Bacterial
Genomic DNA, «h¥Î0.5mlªºÂ÷¤ßºÞ, ¥[¤J¡G
Terminator
Ready Reaction Mix 16.0£gl
Template
¦p»¡©ú5
Primer
6-13 pmol
¤W3¶µ¦Xp40£gl, Y¤£¨¬, ¥[¥hÂ÷¤l¤ô.
1.
¥R¤À²V¦X«á,
Â÷¤ß3000rpm, 5sec, ¦A¥[40£gl mineral oil.
2.
µM«á¶i¦æ¤ÏÀ³25
cycles. ¨ú¥X, Â÷¤ß3000rpm, 5sec.
3.
¦A¶i¦æ¯Â¤Æ.
¡°YµLQuantum
Prep PCR Kleen Spin Columns,¥i±Ä¨H¾ý¯Â¤Æªk:
(1).
±NPCRªºµ²ªG§l¤J¤@¤ä1.5mlÂ÷¤ßºÞ,
¾¨¶q¤£ªgmineral oil.
(2).
¦A¥[¤J80£gl
75¢Misopropanol, ½w³tvortex 10sec, ¸m«Ç·Å15min, Â÷¤ß13,000rpm, 20min,
±N¤W²M²G§l°£.
(3).
¥[¤J250£gl 75¢Misopropanol, ½w³tvortex 10sec, Â÷¤ß13,000rpm,
5min, ±N¤W²M²G§l°£.
(4).
±NºÞ»\¥´¶},
¸mheat block¤W90¢J, 1min, ¨Ï°®Àê.
¡°¥ç¥i±Ä¥Î°sºë¨H¾ýªk¡G
(1).
±NPCRªºµ²ªG§l¤J¤@¤ä1.5mlÂ÷¤ßºÞ,
¾¨¶q¤£ªgmineral oil.
(2).
¦A¥[¤J16£gl¥hÂ÷¤l¤ô,
64£gl
95¢Methanol, ½w³tvortex 10sec, ¸m«Ç·Å15min, Â÷¤ß13,000rpm, 20min,
±N¤W²M²G§l°£.
(3).
¥[¤J250£gl 70¢Methanol, ½w³tvortex 10sec, Â÷¤ß13000rpm, 5min,
±N¤W²M²G§l°£.
(4).
±NºÞ»\¥´¶},
¸mheat block¤W90¢J, 1min, ¨Ï°®Àê.
¡°¥ç¥i±Ä¥Î°sºë»P¾L»Ä¶u¨H¾ýªk¡G
(1).
±NPCRªºµ²ªG§l¤J¤@¤ä1.5mlÂ÷¤ßºÞ,
¾¨¶q¤£ªgmineral oil.
(2).
¦A¥[¤J2£glªº3M
sodium acetate, 50£gl
95¢Methanol, ½w³tvortex 10sec, ¸m«Ç·Å15min, Â÷¤ß13000rpm, 20min,
±N¤W²M²G§l°£.
(3).
¥[¤J250£gl 70¢Methanol, ½w³tvortex 10sec, Â÷¤ß13,000rpm,
5min, ±N¤W²M²G§l°£.
(4).
±NºÞ»\¥´¶},
¸mheat block¤W90¢J, 1min, ¨Ï°®Àê.
¨Ï¥ÎABI
310±Æ§Ç»ö:
1.
±N«e©Ò±o¼Ë¥»·»©ó25£glªºTemplate
Suppression Reagent(TSR)¤¤(ÀHpolymer´£¨Ñ), ½w³tvortex 15sec, Â÷¤ß1000rpm,
10sec, ¸mheat block 95¢J, 2min, ¨Ã¥ß§Y¸m¦B¤W, «Ý¥Î.
2.
n¥Î¦h¤Ö¼Ë¥»¶q»PDNA¼Ò¤lªº«~½è,
¤Þ¤l¥\¯àµ¥§¡¦³Ãö, ¦ý³Ì¤Ö»Ýn10£gl. ±N¼Ë¥»(>10£gl)§l¤J0.5mlºÞ¤¤,
»\¤W¶ë¤l. ½w³tvortex 15sec, Â÷¤ß1,000rpm, 10sec, ¸mheat block 95¢J,
2min, ¨Ã¥ß§Y¸m¦B¤W, «Ý¥Î.
3.
±N·Ç³Æ¦nªºtubes¸m¾÷¾¹¤§¼Ë¥»ºÞ¬[¤W,
¨Ã¦b¯È¤W°O¤U¨C¤äºÞ¤§¼Ë¥»¦W¤Î±Æ¦C¦ì¸m.
4.
ABI 310 ¥Îperformance optimized polymer 6(POP-6¦¹6¥Nªí6¢M)°µ¬°¤ò²ÓºÞ¹qªa§÷(±ÄÁʽs¸¹P/N[part
number] 402844¨ä¤¤¥]¬A2²~TSR). ¦bGeneScan®É¥ÎPOP-4(4¢M)(P/N 402838)¤Î10x
Genetic Analyzer Buffer with EDTA (#402824)(¨Ï¥Î®Éµ}ÄÀ¬°1x).
5.
¤ò²ÓºÞ¥i¦Ü¤Ö¨Ñ100¦¸¼Ë¥»¥Î,
¤£¥Î®É»Ý¬~²b¨Ã±N¨âÀY®û¤Jdeionized water¤¤.
¤ò²ÓºÞªºµ¡¤á³¡¥÷¤£À³¤â´¤, ¦³¦Ç¥i¥H°sºëÀ¿«ø.
6.
Yrun
600-base, ¥Î61cm¤ò²ÓºÞ(¯»¬õ¦âµù°O), ¥ÎSeq POP6 E run module, 200v/cm,
¬ù120min. Yrun 400-base, ¥Î47cm¤ò²ÓºÞ(ºñ¦âµù°O), ¥ÎSeq POP6 Rapid E
run module , 320v/cm, ¬ù35min. ·Å«×§¡¬°50oC. ¥H¤W§¡¥Î1ml°wºÞ,
BD set any primer. ¨Ã¨Ï¥ÎCE-1 basecaller.
7.
±Npump
block¥H¦Û¨Ó¤ô¬~²b, ¦A¥HdH2O¨R¬~, ¥H§j·¾÷·°®, ¥Î1.0ml¬Á¼þ°wµ©½w½w§l0.2ml
POP-6, ±N°w±ì©â§l¼Æ¦¸, ¦A½w½w§l¤J0.5ml POP-6,
Y¦³®ðªw¥²¶·±N°wµ©ª½¥ß«Ý¨Tªw¤W¤É, ¥[¥H±Æ¥X.
8.
¦A¥H»]ÃH¤ô²M¬~°wµ©¥~³¡,
¨Ã¥HKimwipesÀ¿°®, ±N°w¸Ë©ó©w¦ì, Ãöºò¼o®Æ¤f,
¨Ã±Ûºò¥ª°¼¤W¤è¨Ñ¸Ë¶ì½¦°wµ©ªºLuer valve, ¸Ë¦n¤ò²ÓºÞ,
¤ò²ÓºÞ¥ª·ç¥¿¦n¦b°wµ©¤U¥X¤f¤§«e, ±Ûºò¤ò²ÓºÞ±µÀY,
¤ò²ÓºÞ¥t¤@ºÝ(¥k·ç)¶·¶W¹L²ÓÅK¬W0.5mm, (²ÓÅK¬W¥ý¥HdH20À¿²b,
À¿°®). µøµ¡³B³q¹Llaser¥ú²´, Ãö¦n¶Â¦â»\,
¨ä¾l³¡¥÷¥H¶À¦â@¼ö½¦¥¬¶K¦b¥Õ¦â¥[¼öªO¤W.
9.
Turn on»ö¾¹, ¥Ñ¹q¸£¤¤¿ï"about collection software", ¦bManual
control windowÂIFunction pop-up menu, ¦AÂIautosampler present tray¦AÂIexecute,
¦¹®Éautosampler tray·|°h¥X, ±Nsamples¸m©ótray¤W, ¦A¿ïFunction, ÂIautosampler
return tray, ¦AÂIexecute, tray´N°h¦^©w¦ì, §Y¥i±N¥k°¼ªùÃö¤W.
¦A¿ïInstrumentµøµ¡, ÂIChange capillary, «öreset, ¨Ïinjection counter¬°0.
10.¦¹®É,
¨ú13.5ml dH2O¡Ï1.5ml 10x running buffer²V¤Ã, ¥[¤Jbuffer valve
chamber¦Ü¬õ½u³B, ¦A¥[¤Jvial 1¦Ü¶Â½u³B.
±N¦³¬õ½u¤§¬Á¼þ¤pªM¸Ë§´, ±Nvial¸mtray¤§¦ì¸m1, ¸m¥t¤@§tdH2O¤§vial
2©ó¦ì¸m2, §¡¥[¤W¦³¤Õ»\, ¦A¨ú1¥h»\1. 5mlÂ÷¤ßºÞ¸ËdH2O¸m¦ì¸m3.
11.¦¹®É³]©wSyring
Max TravelÈ, ¦b¹q¸£¤W¿ïManual control window, ¿ïFunction, ¦A¿ïSyring
Home, ¦A«öexecute, ¦A¿ïSyring Max Travel, ÂISyring down, «öexecute, ¨C«ö1¦¸,
toggle·|¦V¤U¤@ÂI, «ö¦Ütoggle»P°w±ì¬Û±µ§Y°±, ¦A¿ïSyring up,
¿é¤J250ȦA«öexecute.
12.¦A¿ïBuffer
valve close, «öexecute, ±N¬Á¼þ°wµ©¤U¤è±µÀY²¤ÃP¤@ÂI,
±N°w±ì±À¤@ÂI, ¨Ï¤U¤è±µÀY¤§¥Õ¦âºÞÀY²{¥X1ºwpolymer¥H¥h°£ªÅ®ð,
¦A±N¤U¤è±µÀY±Ûºò. ¦A¿ïbuffer valve open, «öexecute,
±N°w±ì±À¤@ÂI¨Ïpolymer¥R¶ñ¦Ü¥ª°¼¤W¤è±µÀY¤§¤Uªñ±×©YºÞ³B,
¦A¿ïbuffer valve close, «öexecute, ¦A¿ïSyring down, «öexecute,
¥i¦h«ö¤L¦¸, ¨Ïpolymer¥R¦Ü±×©YºÞ¤ºº¡¬°¤î. ¦A¥Ñfunction¤¤¿ïtemperature,
³]©w¬°50¢J, «öexecute.
13.¦¹®É¿ïAutosampler
calibration, «östart, ¦A«öABI 310¾÷¾¹¥ª°¼¤§trayÁä, ¨Ïtray²¾°Ê¤@¤U,
¿ïautosampler home x, y, axis, ¦A«öexecute, ¦A¿ïautosampler Z axis, ¦A«öexecute,
¦A¿ïsyring home, «öexecute. Ãö¤W¾÷¾¹©Ò¦³¤§ªù.
14.¥ÑFile¶µ¿ïnew,
¦A¿ïsequence sample sheet 48 tubes, ¿é¤Jsample¦WºÙ, quit¦¹window, ¦A«ösave,
²Ä2¦¸¦A«ösave. ¦A¥Ñfile, ¿ïnew, ¦A¿ïsequence injection lift, ¿ïsample
sheet, ¿ï¥X¤è¤~«ØªºÀɦW, ¦A¿ïA1-1§Y²Ä1¦æ²Ä1®æ. ¦¹®É¿ïEdit,
¦A¿ïinsert, ¿ï¤@Ó¦WºÙ, «öºñ¦â½bÀY§Yrun. »ö¾¹¦Û°Êrun¦Üµ²§ô.
Y¦AÄòrun, ¥ýquit injection lift, ¦Asave, ¦A¿ïautosampler present tray
«öexecute, ¨ú¥XÂÂsamples, ©ñ¤J·ssamples, ¦A«öreturn tray, ¦A¿ïsyring
home x,y,¡K..¨Ì«ez¨BÆJ.
15.¤ÀªRData,
¥Îsequence analysis, ¿ïadd file, ¦A¿ïABI 310, «öABI Prism 310, «öopen, «öruns,
¦A«öopen, ¿ï©Ònªºfile, «öopen, ¿ïn¤ÀªR¤§sample, «öadd file,
¦A«ödone, ¦A«östart, «ösample file¤§¦W, execute, §Y¥i¬Ýµ²ªG, ¦A«öP,
«östart, §Y¥i¦L¥X.
°µ±½ºË¤ñ¸û(Gene Scan)¥Î
¨Ï¥ÎFluorescent
Genotyping Demonstration Kits A(#402246)©ÎB(#402247), Kit A¥iamplify PCR
products, Kit B«h¥Î©ó·~¤w¸gPCR amplified ¤§¼Ë¥».
¥t¶·Fluorescent
Amidite Matrix Standatds (#401546)
Deionized
formamide
filter-sterilized
deionied water
Y¥ÎKit B«h©|¶·GeneScan-350
size standard(#401736)
ABI
Prism 310 10x Genetic Analyzer buffer with EDTA (#402824)
POP-4(#402838)µ¥§÷®Æ.
¦b±N¾÷¾¹¥Ñ°µ±Æ§ÇÂà´«¬°±½ºË¥Î®É,
¶·¥ý±N¤ò²ÓºÞ, gel block, ¬ÁÂ÷°wµ©§¡¬~²b, «¸Ë. ¨Ã·Ç³Æ¦n1x¤§Genetic
Analyzer buffer with EDTA 50ml.
ª`·N¡G
gel
blockµ´¤£¥i¥H¥ô¦ó¦³¾÷·»¾¯³B²z. ¥þµ{¶·±a¤â®M. ¥R¶ñgel¤è¦¡¦P±Æ§Ç¨BÆJ,
¥u¬Ogel¬°POP-4.
1.
¥Ñ¹q¸£¤¤¿ïAbout
collection software, ¥Ñwindow¤¤¿ïPerferences, ¦A¿ïSequence injection list
Default, ©ÎGeneScan injection List default, Y¹q¸£n¨D«h¿é¤J139115, «öOK,
¦A¿ïCollection Software¤@¦¸.
2.
¥ÑManual
Control window¤§Function¶µ, ¿ïSyringe Home «öexecute, ¦A¥ÑFunction¶µ¤¤¿ïSyringe
Max travel, °O¤U©ÒÅã¥Ü¼Æ¾Ú, ¦A«öSyringe Down,
¿é¤J«e¶µ©ÒÅã¥Ü¼Æ¾Ú, «öexecute, ¦b°w±ì±À¶i¾¹»P°w±ì¬Û±µ®É,
°±¤î, ¥Ñwindow¤¤¿ïStatus.
3.
¦binjection¶µ¤U°O¤U¼Æ¾Ú,
±N¦¹¼Æ¾Ú´î15, ¦A¿ïSyringe Max Travel, ±N¤Wz´î¥h15¤§¼Æ¾Ú¿é¤J,
«öexecute, ±N¼Æ¾Ú§Û¦b»ö¾¹¥ª°¼ªù¤º.
4.
¦A¿ïSyringe
Up, ¿é¤J250, «öexecute, ¡K¡K¨ä¾l¸Ë¤ò²ÓºÞ, ¸Ëgel,
¸Ë¼Ë¥»¤è¦¡§¡¦P°µ±Æ§Ç¤è¦¡, µM«á, ¥ÑInstrument¶µ¿ïchange
capillary, ¦bReset¶µ«öOK, ¨Ïinjection counter³]¬°0. ¦A¥ÑManual control¤¤¿ïtemperature¿é¤J60¢J,
«öexecute.
·Ç³Æ¼Ë¥»¡G
1.
·Ç³Æ14¤ä0.5mlÂ÷¤ßºÞ,
¤À2¦C, ¨C¦C8¤ä, ¨C¦C²Ä7»P²Ä8¤ä³æ¿W©ñ, (²¼g¬°A1~A8, B1~B8)
2.
±NKit
A¸m¦B¤W¸Ñá, ±N²Ä1¦C¤§A1~A6¤Î²Ä2¦CB1~B6¦U¤ä¤¤, ¦U¥[¤J9£gl Reagent mix, ¦A¥[3£gl¤§control DNA 1347-02©óA1~A6¤¤,
¦A©óB1~B6¤¤¦U¥[3£gl
Control DNA 1347-10.
3.
¦bA1,B1¤¤¦U¥[3£gl D12S83-[FAM].
4.
¦bA2,B2¤¤¦U¥[3£gl D7S517-[FAM].
5.
¦bA3,B3¤¤¦U¥[3£gl D2S391-[TET].
6.
¦bA4,B4¤¤¦U¥[3£gl D13S171-[TET].
7.
¦bA5,B5¤¤¦U¥[3£gl D1S220-[HEX].
8.
¦bA6,B6¤¤¦U¥[3£gl D3S266-[HEX].
9.
µM«á¨C¤ä¤¤¦U¥[40£gl
mineral oil, »\¦nºÞ»\, Â÷¤ß1500rpm, 15sec.
10.¦A¶i¦æPCR,
95¢J, 12min, 1 cycle.
11.¦A94¢J,
15sec, 55¢J, 15sec, 72¢J, 30 sec, 10 cycles.
12.¦A89¢J,
15 sec, 55¢J, 15 sec, 72¢J, 30sec, 20 cycles.
13.¦Afinal
extention 72¢J, 30min, «O¦s¦b4¢J.
14.¤§«á¥ÑA1,
A2¤¤¦U¨ú7.5£gl, A3, A4¤¤¦U¨ú5£gl, A5, A6¤¤¦U¨ú10£gl, ¸m¤JA7¤¤.
15.¦P¼Ë±NB1,
B2¤¤¦U¨ú7.5£gl, B3, B4¤¤¦U¨ú5£gl, B5, B6¤¤¦U¨ú10£gl, ¸m¤JB7¤¤.
16.¦A¥ÑA7¤¤¨ú1£gl¸m¤JA8, ¥ÑB7¤¤¨ú1£gl¸m¤JB8. (Y¨Ï¥ÎKit B«h¦U¬°2£gl).
17.µM«á¤è¤lA8,
B8¤¤¦U¥[¤Jformamide size standard mix 12£gl. ±NA8, B8Â÷¤ß1,000rpm,
15sec, ¸m95¢J, 5min, ¸m¦B¤W.
·Ç³Ædeionized
formamide¡G
1.
50ml¥[5g ion-exchange formamide resin(AG501¡Ñ8 from BioRad), ÅÍ©Õ30min,
¥H¸Õ¯È´úpHY¦b7~9¤§¶¡«h¥i.
2.
±Ndeionized
formamide¥H2 micronÂo¾¹¹LÂo, ¤À500£gl«O¦s-20¢J. Y¦b7~9¤§¶¡«h¥i
3.
±Nformamide§l¤J¥t¤@¥[¦³5g
ion-exchange¤§¿NªM¦AÅÍ©Õ30min, ¥H¸Õ¯È´úpHY¦b7~9¤§¶¡«h¥i, ¤À500£gl«O¦s.
·Ç³Æformamide
size standard mix¡G
1.
5£gl size standard¡Ï12£gl deionized formamide,
½w³tvortex 5sec, Â÷¤ß1000rpm, 15sec, «O¦s©ó4¢J.
·Ç³ÆMatrix
standard samples¡G
1.
1£gl matrix standard¡Ï12£gl deionized formamide,
½w³tvortex 5sec, Â÷¤ß1000rpm, 15sec, «O¦s©ó4¢J.
Denature
Matrix standard samples¡G
1.
±Nsample¸m95¢J
5min, ¦A¸m¦B¤W«Ý¥Î.
2.
µM«á,
±N¤Wz¼Ë¥»¨ÌA7, A8, ¤Î4Ïúmatrix standard samples¤À§O¸mautosampler
tray¤Wªº¥k°_²Ä1±Æ¤§1~6¦ì¤W. ¦ÓKit Bªº¼Ë¥»¸m¥t¤@tray¤W±Æ¦C¤è¦¡¤ñ·Ó.
3.
¦A·Ç³ÆGenescan
sample sheet, ¨ÌKit A©ÎB¤À§O³]©w, ¦A³]©wGenescan injection list,
¾÷¾¹·|¦Û°Ê°õ¦æ¨C¼Ë¥»1¦¸, Yn¦h©ó1¦¸, n«Âг]©w, ¦b²Ä1¼Ë¥»«e,
¥[1¦æ, ³]©wmodule¬°Test CCD4-color, ¦p±Æ§Ç®É¤@¼Ë, ¦ýcollection time§ï¬°1min,
¥H´ú¤ò²ÓºÞ¸Ë¸m¬O§_§´·í, YbaselineÈ¡Õ2,068«h¥i. ¦A«öRun«h¶}©l.
¦brun®É, ¥iÀH®É¥Ñ¹q¸£ºÊ¬Ý.
4.
³]©wGeneScan
Matrix File¤è¦¡»P±Æ§ÇÃþ¦P.
5.
Runµ²§ô, ¤£½×±Æ§Ç©ÎScan§¡n±N¬Á¼þ°wµ©¬~²b, ¥[dH2O
250£gl, Ãö±¼©Ò¦³valves, ±NSyringe
drive²¾¦Ü250³B, µM«árun Seq Fill Capillary module, ¨Ïpolymer¬~²b, ¬ù6min.
±N¤ò²ÓºÞ¨ú¥X¨â·ç´¡¤J§t¤ôÂ÷¤ßºÞ¤¤«O¦s.